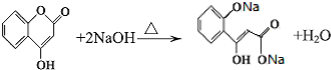
题目内容
3. 烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染.
写出CH4与NOx反应的化学方程式.4NOx+xCH4→2N2+xCO2+2xH2O
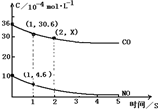
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)?N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出如图.
前1S内平均反应速率v(N2).2.2.7×10-4mol/(L•s)
第2S时的X值范围.30.6>x>25.2
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏.而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气.说明理由:熟石灰悬浊液吸收SO2速度快且脱硫率高.澄清石灰水中Ca(OH)2浓度较小,吸收SO2的量少;熟石灰固体与气体接触面小吸收速度慢且脱硫率低
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量.写出此测定方法的离子方程式.5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(5)双碱法是一种低成本高效率的脱硫方法.先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用.可用作第一碱a.可用作第二碱cd.(选填编号)
a NaOH b Mg(OH)2 c 石灰石 d 石灰.
分析 (1)氮的氧化物与甲烷反应转化为无害成分,则应生成氮气、二氧化碳、水;
(2)利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(N2);根据随着反应进行反应速率越来越小分析;
(3)氢氧化钙的溶解度较小,吸收SO2的量少;
(4)酸性高锰酸钾与二氧化硫发生氧化还原反应,二氧化硫被氧化为硫酸根离子,高锰酸钾被还原为锰离子,根据元素守恒,同时有氢离子生成;
(5)开始的烟气中二氧化硫的含量较高,所以第一碱为NaOH溶液;脱硫废液在另一反应器中再与第二碱反应,则该废液中二氧化硫的含量较少,所以选择石灰石或石灰均可.
解答 解:(1)根据元素守恒,氮的氧化物与甲烷反应转化为无害成分,则应生成氮气、二氧化碳、水,化学方程式是4NOx+xCH4→2N2+xCO2+2xH2O,
故答案为:4NOx+xCH4→2N2+xCO2+2xH2O;
(2)一氧化碳的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×10{\;}^{-4}mol/L}{1s}$=5.4×10-4mol/(L.s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,
故答案为:2.7×10-4mol/(L.s);30.6>x>25.2;
(3)因为氢氧化钙的溶解度较小,得到的澄清石灰水的浓度较小,吸收SO2的量少,所以熟石灰悬浊液吸收SO2速度快且脱硫率高.熟石灰固体与气体接触面小吸收速度慢且脱硫率低,所以不用澄清石灰水或熟石灰的固体吸收二氧化硫,
故答案为:熟石灰悬浊液吸收SO2速度快且脱硫率高.澄清石灰水中Ca(OH)2浓度较小,吸收SO2的量少;熟石灰固体与气体接触面小吸收速度慢且脱硫率低;
(4)酸性高锰酸钾与二氧化硫发生氧化还原反应,二氧化硫被氧化为硫酸根离子,高锰酸钾被还原为锰离子,根据元素守恒,同时有氢离子生成,离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(5)开始的烟气中二氧化硫的含量较高,所以第一碱为NaOH溶液;脱硫废液在另一反应器中再与第二碱反应,则该废液中二氧化硫的含量较少,所以选择石灰石或石灰均可,生成的硫酸钙被氧气氧化最终得到硫酸钙,可被重新利用,故答案为:a;cd.
点评 考查氮的氧化物与二氧化硫的性质、对工艺的分析以及环境污染等,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 镁:2MgO (熔融)$\stackrel{通直流电}{→}$Mg+O2↑ | B. | 钙:CaO+C$\stackrel{高温}{→}$Ca+CO↑ | ||
| C. | 锰:3MnO2+4Al$\stackrel{高温}{→}$3Mn+2Al2O3 | D. | 汞:HgS$\stackrel{加热}{→}$Hg+S |
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 热稳定性:H2S>H2O>HF | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>Cl2>Br2 |
| A. | 常温常压下,22.4 L NO2中含有NA个分子 | |
| B. | 1 mol羟基中电子数为10 NA | |
| C. | R2+的质量数为A,中子数为N,则n g R该价态的氧化物中含质子数为$\frac{n}{A+16}$(A-N+8)NA | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定氨水的浓度 | 锥形瓶、滴定管、烧杯 | 氨水、1mol/L盐酸、甲基橙 |
| B | 制备Fe(OH)3胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液、NaOH溶液 |
| C | 检验丙烯醛中的碳碳双键 | 试管、胶头滴管 | 丙烯醛、溴水 |
| D | 配制100mL1mol/L硫酸 | 容量瓶、胶头滴管、10mL量筒、烧杯 | 18mol/L硫酸、蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ③④ | B. | ②③④ | C. | ②③ | D. | 全部 |
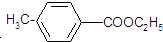 )是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
)是用于合成药物的中间体.请根据下列转化关系图回答有关问题: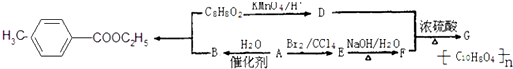
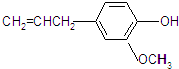
 .
.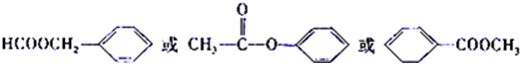 .
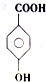
. )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号).
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号).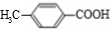 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$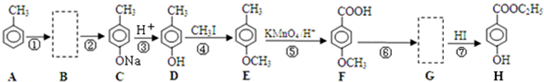
 .
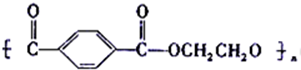
. )在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式
)在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式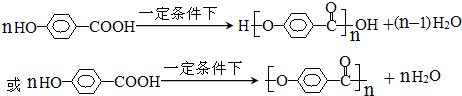 .
.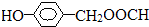 .
.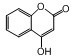 是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
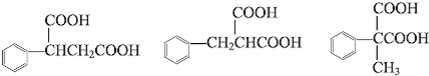 中的任意一种.
中的任意一种.