题目内容
5.下列叙述正确的是( )| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 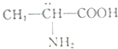 分子属于手性分子 分子属于手性分子 |
分析 A.价电子排布为4s24p2的元素属于主族元素,周期数=电子层数,主族族序数=最外层电子数,最后填充p能级,属于p区元素;
B.利用等效氢判断;
C.原子由基态变成激发态需要吸收能量;
D.含有手性碳原子的分子属于手性分子,手性碳原子是指连接四个不同的原子或基团的碳原子.
解答 解:A.价电子排布为4s24p2的元素属于主族元素,位于第四周期第ⅣA族,最后填充p能级,属于p区元素,故A错误;
B.1,2-二甲苯有3种化学环境不同的H原子,核磁共振氢谱中有三组峰,且氢原子数之比为6:2:2=3:1:1,故B正确;
C.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,故C错误;
D.分子中羧基连接的碳原子为手性碳原子,属于手性分子,故D正确,
故选BD.
点评 本题考查原子核外电子的排布、元素周期表、原子核外电子的跃迁、核磁共振氢谱、手性分子等,题目难度中等,注意掌握原子核外电子的跃迁过程中能量变化,电子排布规律及电子排布与元素位置的关系,注意规律性知识的总结和应用.

练习册系列答案
相关题目
15.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,22.4 L NO2中含有NA个分子 | |
| B. | 1 mol羟基中电子数为10 NA | |
| C. | R2+的质量数为A,中子数为N,则n g R该价态的氧化物中含质子数为$\frac{n}{A+16}$(A-N+8)NA | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
16.下列化学用语正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | Cl-结构示意图: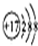 | ||
| C. | CO2的比例模型: | D. | 质量数为23的钠原子:${\;}_{23}^{11}$Na |
13.下列物质①Na2CO3②Al③Al2O3④Al(OH)3中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | ③④ | B. | ②③④ | C. | ②③ | D. | 全部 |
20.下列各组物质中,互为同分异构体的是( )
| A. | CH3CH2OH 和CH3OCH3 | B. | 淀粉和纤维素 | ||
| C. | 金刚石和石墨 | D. | CH3CH2CH3和CH3CH2CH2CH3 |
10.下列各组中的两种有机物一定互为同系物的是( )
| A. | CH4O和C2H6O | B. | C2H4和C6H12 | C. | C2H2和C4H6 | D. | CH4和C3H8 |
17.下列说法正确的是( )
| A. | Cl-的半径比Cl的半径小 | |
| B. | Cl2和Cl-都有毒性 | |
| C. | Cl-和Cl2都呈黄绿色 | |
| D. | Cl、HClO、Cl2及Cl-中,Cl的化学活动性最强 |
2.在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,它们在元素周期表中的位置如下:
在a~k11种元素中:
(1)写出a、e、g的元素符号:aH、eNa、gP.
(2)原子最外层电子数是最内层电子数2倍的是C,原子半径最大的是K,最高价氧化物对应水化物酸性最强的元素是Cl.
(3)剩余的元素中,离子电子层结构相同,且带电量也相同,但电性相反的两种元素是O和Mg.(以上各空均填元素符号)
(4)写出c元素单质的电子式: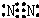 .
.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | a | ||||||
| 二 | b | c | d | ||||
| 三 | e | f | g | h | i | ||
| 四 | j | k | |||||
(1)写出a、e、g的元素符号:aH、eNa、gP.
(2)原子最外层电子数是最内层电子数2倍的是C,原子半径最大的是K,最高价氧化物对应水化物酸性最强的元素是Cl.
(3)剩余的元素中,离子电子层结构相同,且带电量也相同,但电性相反的两种元素是O和Mg.(以上各空均填元素符号)
(4)写出c元素单质的电子式:
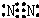 .
.
3.下列说法正确的是( )
| A. | 用如图装置除去乙烷中混有的乙烯 | |
| B. | 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大 | |
| C. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| D. | 玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |