题目内容
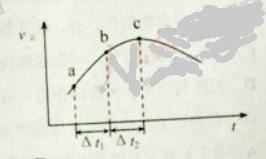
【题目】下列各表述与示意图一致的是
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】
A项,酸碱中和滴定接近终点时,pH发生突跃,A错误;
B项,2SO2(g) + O2(g)![]() 2SO3(g) ΔH < 0,正反应放热,逆反应吸热,所以正反应平衡常数随温度升高而减小,逆反应平衡常数随温度升高而增大,B正确;
2SO3(g) ΔH < 0,正反应放热,逆反应吸热,所以正反应平衡常数随温度升高而减小,逆反应平衡常数随温度升高而增大,B正确;
C项,高锰酸钾与草酸反应时,刚开始反应较慢,反应产生的Mn2+对反应起催化作用,故后面反应速率较快,图中未表示出来,C错误;
D项,ΔH < 0的反应反应物总能量大于生成物总能量,D错误;
答案选B。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
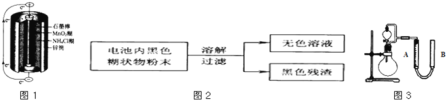
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.