Ő‚ńŅńŕ»›
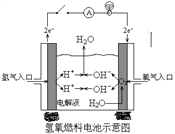
°ĺŐ‚ńŅ°ŅłŖŐķĶÁ≥ō «“Ľ÷÷–¬–ÕŅ…≥šĶÁĶÁ≥ō£¨”Ž∆’Õ®łŖń‹ĶÁ≥ōŌŗĪ»£¨ł√ĶÁ≥ōń‹≥§ ĪľšĪ£≥÷ő»∂®Ķń∑ŇĶÁĶÁ—Ļ£¨łŖŐķĶÁ≥ōĶń◊‹∑īő™£ļ3Zn+2K2FeO4+8H2O ![]() 3Zn£®OH£©2+2Fe£®OH£©3+4KOH£¨Ō¬Ń––ū Ų≤Ľ’ż»∑Ķń «£® £©
3Zn£®OH£©2+2Fe£®OH£©3+4KOH£¨Ō¬Ń––ū Ų≤Ľ’ż»∑Ķń «£® £©
A.∑ŇĶÁ Īłļľę∑ī”¶ Ĺő™£ļZn©Ā2e©Ā+2OH©Ā=Zn£®OH£©2
B.∑ŇĶÁ Ī√Ņ◊™“∆3molĶÁ◊”£¨’żľę”–1 mol K2FeO4ĪĽĽĻ‘≠
C.≥šĶÁ Ī“űľęłĹĹŁ»‹“ļĶńľÓ–‘‘Ų«Ņ
D.∑ŇĶÁ Ī’żľę∑ī”¶ Ĺő™£ļFe£®OH£©3©Ā3e©Ā+5OH©Ā=FeO42©Ā+4H2O
°ĺīūįł°ŅD
°ĺĹ‚őŲ°ŅĹ‚£ļA£ģłýĺ›ĶÁ≥ōĶń◊‹∑ī”¶Ņ…÷™£¨łŖŐķĶÁ≥ō∑ŇĶÁ ĪĪō∂® «–Ņ‘ŕłļľę ß»•ĶÁ◊”£¨ĶÁľę∑ī”¶ Ĺő™Zn©Ā2e©Ā+2OH©Ā=Zn£®OH£©2 £¨ Ļ A’ż»∑£Ľ
B£ģ∑ŇĶÁ Ī’żľę∑ī”¶ő™FeO42+4H2O+3e©Ā=Fe£®OH£©3+5OH©Ā £¨ √Ņ◊™“∆3molĶÁ◊”£¨’żľę”–1molK2FeO4ĪĽĽĻ‘≠£¨Ļ B’ż»∑£Ľ
C£ģ≥šĶÁ Ī“űľę∑Ę…ķZn£®OH£©2=Zn©Ā2e©Ā+2OH©Ā £¨ ľÓ–‘‘Ų«Ņ£¨Ļ C’ż»∑£Ľ
D£ģ∑ŇĶÁ Ī’żľę∑ī”¶ő™FeO42+4H2O+3e©Ā=Fe£®OH£©3+5OH©Ā £¨ Ļ DīŪőů£ģ
Ļ —°D£ģ

°ĺŐ‚ńŅ°ŅĽĮ—ß‘ŕ…ķĽÓ÷–”–◊ŇĻ„∑ļĶń”¶”√£¨Ō¬Ń–∂‘”¶ĻōŌĶ’ż»∑Ķń «£®£©
—°ŌÓ | ĽĮ—ß–‘÷ | Ķľ ”¶”√ |
A | Al2(SO4)3ļÕň’īÚNa2CO3»‹“ļ∑ī”¶ | Ň›ń≠√ūĽū∆ų√ūĽū |
B | ”Õ÷¨‘ŕňŠ–‘ŐűľĢŌ¬ĶńňģĹ‚∑ī”¶ | Ļ§“Ķ…ķ≤ķ÷–÷∆»°∑ ‘Ū |
C | ī◊ňŠĺŖ”–ňŠ–‘ | ≥ī◊≥żňģĻł |
D | SO2ĺŖ”–∆Įį◊–‘ | Ņ…”√”ŕ ≥∆∑‘Ųį◊ |
A.AB.BC.CD.D