题目内容
【题目】![]() 时,氯水中部分含氯的物种的分布分数
时,氯水中部分含氯的物种的分布分数![]() 平衡时某物种的浓度占各物种浓度之和的百分数
平衡时某物种的浓度占各物种浓度之和的百分数![]() 与pH的关系如图所示。下列叙述不正确的是( )
与pH的关系如图所示。下列叙述不正确的是( )
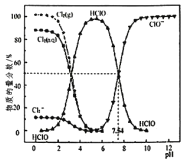
A.新制氯水中持续通入![]() ,pH不断变小,溶液颜色不断变浅
,pH不断变小,溶液颜色不断变浅
B.新制的![]() 的氯水中,
的氯水中,![]()
C.![]() 时,
时,![]() 的电离常数Ka的对数值为
的电离常数Ka的对数值为![]()
D.![]() 的氯水中加入NaOH溶液,主要发生的离子反应方程式为
的氯水中加入NaOH溶液,主要发生的离子反应方程式为![]()
【答案】D
【解析】
A、二氧化硫与氯气发生氧化还原反应,生成硫酸和盐酸,反应的方程式为:![]() ,所以pH不断变小,溶液颜色变浅,选项A正确;
,所以pH不断变小,溶液颜色变浅,选项A正确;
B、氯水中电荷守恒,![]() ,所以
,所以![]() ,又HClO电离
,又HClO电离![]() ,所以
,所以![]() ,选项B正确;
,选项B正确;
C、由电离![]() 可知,
可知,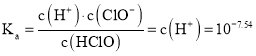 ,所以
,所以![]() 的对数值为
的对数值为![]() ,选项C正确;
,选项C正确;
D、由图可知随反应的进行次氯酸的浓减小,所以次氯酸是反应物;而次氯酸根离子的浓度增大,次氯酸根是生成物,所以![]() 的氯水中加入NaOH溶液,主要发生的离子反应方程式为
的氯水中加入NaOH溶液,主要发生的离子反应方程式为![]() ,选项D错误;
,选项D错误;
答案选D。

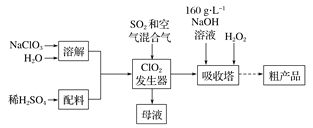
【题目】下列有关实验的操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 实验结论 |
A | 向某溶液中加入硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有 |
B | 将 | 无白色沉淀生成 |
|
C | 向某溶液中加入少量双氧水后,再滴加几滴KSCN溶液 | 溶液变红色 | 原溶液中可能含有 |
D | 向某溶液中滴加稀盐酸 | 有气泡产生 | 原溶液中一定含有 |
A.AB.BC.CD.D
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A.前 5 min 的平均反应速率为v(SO2) = 0.08 mol/(L·min)
B.保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时, v正 > v逆
C.保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D.相同条件下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%