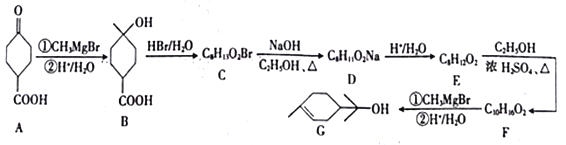
题目内容
【题目】为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如下图,填写图中的空白。
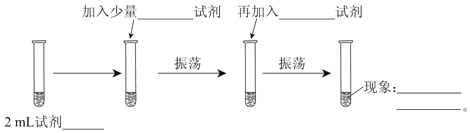
(1)2 mL试剂_______________;
(2)加入少量___________试剂;
(3)再加入___________试剂;
(4)现象_____________________________________________________。
(5)可以证明Cl2的氧化性____________(填强于、弱于)Br2的氧化性。
(6)发生反应的离子反应方程式为_______________________________。
【答案】NaBr溶液氯水四氯化碳滴入氯水后溶液呈橙色,加入四氯化碳后,液体分层且下层呈橙红色强于Cl2+2Br-=Br2+2Cl-
【解析】
根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于溴的氧化性,只要使氯气和溴的盐溶液混合观察是否有溴单质生成,如果有溴单质生成就说明氯气的氧化性大于溴单质,否则不能证明。
要想比较氯气和溴单质的氧化性大小,做如下实验:少量溴化钠溶液→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴。则
(1)根据以上分析可知,2 mL试剂为NaBr溶液;
(2)根据以上分析可知,加入少量氯水试剂;
(3)根据以上分析可知,再加入四氯化碳试剂;
(4)根据以上分析可知,实验现象为滴入氯水后溶液呈橙色,加入四氯化碳后,液体分层且下层呈橙红色。
(5)根据以上分析可知,氯气能将溴单质置换出来,因此该实验可以证明Cl2的氧化性强于Br2的氧化性。
(6)根据以上分析可知发生反应的离子反应方程式为Cl2+2Br-=Br2+2Cl-。

 阶梯计算系列答案
阶梯计算系列答案【题目】请用图中所示实验装置证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用图示装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:
实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
① | 15mL | 无 | |
② | 15mL | CuO(0.5g) | |
③ | 15mL | MnO2(0.5g) |
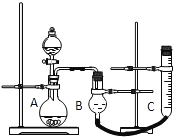
(1)从实验原理来看,实验中的“待测数据”可以指___________,也可以指___________。
(2)实验时气体收集在B中,B仪器名称是___________。若要检验产生的气体是O2,待气体收集结束后,用弹簧夹夹住B下端乳胶管,打开单孔橡皮塞,___________。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体步骤):a.证明CuO的化学性质没有变化,b.______________。
(4)实验开始时,当往容器中加入一定量的双氧水后,由于短时间内产生大量气体,分液漏斗内的液体不能顺利流下,为了解决这个问题,你采取的措施是______________;在测量生成的气体体积时,除了要注意视线与凹液面相平以外,还应注意__________。