题目内容
18. (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;②1molH2生成NH3需放出(吸收或放出 )热量30.7KJ
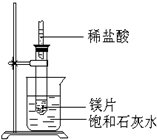
(2)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
①实验中观察到的现象是镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体.
②产生该现象的原因镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体.
③有此推知,MgCl2溶液和H2的总能量小于(填“大于”“小于”或“等于”)镁片和盐酸的总能量.
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量;
(2)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答;
解答 解:(1)反应热=化学键断裂吸收的总能量-化学键形成放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量;
1mol H2生成NH3的反应热=$\frac{1}{3}$×946kJ+436kJ-$\frac{2}{3}$×3×391kJ=-30.7kJ,所以是放出热量;
故答案为:①放出;92 ②放出;30.7;
(2)①镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为:镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体;
故答案为:镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体;
②镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出;故答案为:镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量;
故答案为:小于.
点评 本题考查了反应热的计算以及通过镁与盐酸的反应,考查了放热反应、氢氧化钙溶解度特点,题目难度不大,注意对基础知识的积累.

 高中必刷题系列答案
高中必刷题系列答案①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
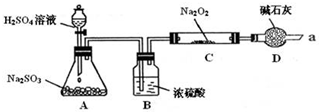
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
②哪一段时段的反应速率最小4~5min,原因是H+浓度小.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是AB.
| A. | 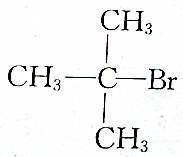 | B. | 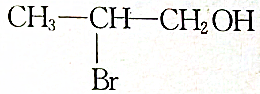 | ||
| C. | 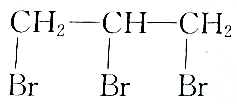 | D. | 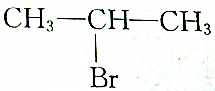 |
| A. | 淀粉和蛋白质水解的最终产物都只有一种 | |
| B. | 蔗糖和淀粉都不能发生氧化反应 | |
| C. | 棉花、合成纤维、ABS树脂、蚕丝和核酸都属于高分子化合物 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
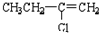 (C)
(C)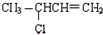 (D)
(D)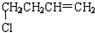
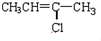 (G)
(G)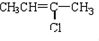 (H)
(H)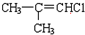
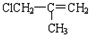 (J)
(J)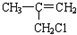
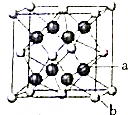 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.