题目内容
【题目】有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,在元素周期表中,A的原子半径最小,B的族序数是其所在周期序数的2倍,D是地壳中含量最多的元素,在元素周期表中A和E同主族。试回答下列问题:
(1)化合物![]() 的电子式为______。
的电子式为______。
(2)化合物![]() 的电子式为______。
的电子式为______。
(3)C的简单氢化物与C的最高价氧化物对应水化物反应生成的盐的化学式为______。
(4)将物质的量之比为1:1的![]() 和
和![]() 组成的混合气体通入到a mol的过量固体
组成的混合气体通入到a mol的过量固体![]() 中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
【答案】![]()
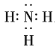
![]() 0.25 2.8
0.25 2.8
【解析】
A为元素周期表中原子半径最小的元素,则A为H元素;D是地壳中含量最多的元素,则D是氧元素;A、B、C、D、E五种短周期主族元素的原子序数依次增大,B的族序数是其所在周期序数的2倍,则B是碳元素、C是氮元素;A和E同主族,则E是钠元素。
(1)化合物![]() 为
为![]() ,
,![]() 为共价化合物,其电子式为
为共价化合物,其电子式为![]() ,
,
故答案为:![]() ;
;
(2)化合物![]() 为
为![]() ,电子式为
,电子式为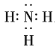 ,
,
故答案为: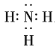 ;
;
(3)C是N元素,其简单氢化物为![]() ,其最高价氧化物对应水化物为
,其最高价氧化物对应水化物为![]() ,
,![]() 与
与![]() 反应生成
反应生成![]() ,
,
故答案为:![]() ;
;
(4)![]() 为
为![]() ,由题意可知,
,由题意可知,![]() 和
和![]() 组成的混合气体与过量
组成的混合气体与过量![]() 反应得到碳酸钠、氢氧化钠和过氧化钠的固体混合物,加入到 500 mL
反应得到碳酸钠、氢氧化钠和过氧化钠的固体混合物,加入到 500 mL![]() 的盐酸中,碳酸钠、过氧化钠与盐酸反应生成标准状况下b L二氧化碳和氧气的无色混合气体,反应后溶液呈中性说明盐酸与固体混合物恰好完全反应得到氯化钠溶液,由电荷守恒和钠原子守恒可得,
的盐酸中,碳酸钠、过氧化钠与盐酸反应生成标准状况下b L二氧化碳和氧气的无色混合气体,反应后溶液呈中性说明盐酸与固体混合物恰好完全反应得到氯化钠溶液,由电荷守恒和钠原子守恒可得,![]() ,则
,则![]() ;设
;设![]() 和
和![]() 的物质的量均为x mol,x mol
的物质的量均为x mol,x mol![]() 与x mol
与x mol![]() 反应生成x mol
反应生成x mol ![]() , x mol
, x mol ![]() 与x mol
与x mol![]() 反应生成2x mol
反应生成2x mol![]() ,x mol
,x mol![]() 与盐酸反应生成x mol
与盐酸反应生成x mol ![]() ,
,![]()
![]() 与盐酸反应生成
与盐酸反应生成![]()
![]() ,则
,则![]() ,
,
故答案为:0.25;2.8。

 口算能手系列答案
口算能手系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤
(1)配制待测白醋溶液,用____(填仪器名称)量取10.00 mL食用白醋,在____(填仪器名称)中用水稀释后转移到100 mL____(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是____,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3~4次。
(5)如图是某次滴定时的滴定管中的液面,其读数为____mL。
![]()
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)按正确数据处理,得出c(市售白醋)=____mol/L,市售白醋总酸量=____g·100 mL-1。