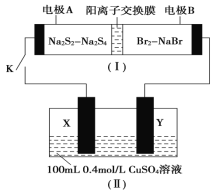
题目内容
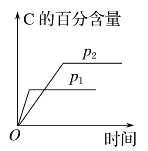
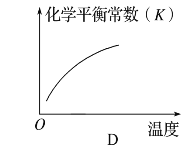
【题目】可逆反应aA(g)+bB(g)![]() cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
A.Q>0
B.增大压强,B的转化率增大
C.当反应达平衡时,混合气体的密度不再变化
D.p1>p2,a+b<c
【答案】B
【解析】
A.由图可知,随着温度升高,平衡常数逐渐增大,说明平衡向正向移动,因此正向为吸热反应,Q>0,故A不符合题意;
B.根据“先拐先平”可知,p1>p2,增大压强,C的百分含量减小,说明平衡逆向移动,因此增大压强B的转化率将减小,故B符合题意;
C.该反应中D为固体,因此在反应未达到平衡状态时,气体的总质量会发生变化,当反应达到平衡状态时,气体总质量不变,气体体积不变,混合气体的密度不再变化,故C不符合题意;
D.由B可知,p1>p2,增大压强,平衡逆向移动,增大压强,平衡向气体体积减小的方向移动,因此a+b<c,故D不符合题意;
故答案为:B。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________)
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min内H2的平均反应速率为v(H2)=__。该温度下,反应(ⅰ)的平衡常数K=__。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是(_________)
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:
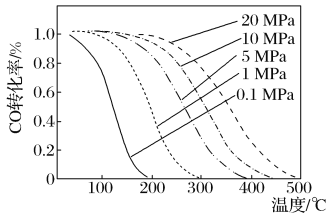
由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__。