��Ŀ����
����Ŀ�������ӵ�������ֵ�� NA ��ʾ������˵������ȷ���ǣ� ��
A.33.6L ��ϩ(��״��)������ HCl �����ӳɷ�Ӧ������ 1-�ȱ������Ϊ1.5NA
B.14g ����ʽΪCnH2n �������к��е�C��H ������ĿΪ NA
C.2mol �������� 4mol �Ҵ�һ�������³�ַ�Ӧ������������������Ϊ 2NA
D.1L lmol/L ����������Һ�У����������ǻ��ĸ���Ϊ 5NA
���𰸡�D
��������
A����ϩ��HCl�ӳɿ�������1-�ȱ��飬Ҳ��������2-�ȱ��飬����33.6L��ϩ(��״��)������HCl�����ӳɷ�Ӧ������1-�ȱ������С��1.5NA��A����
B��14g����ʽΪCnH2n�������к��е�C��H�������ʵ�����![]() ����ĿΪ2NA��B����
����ĿΪ2NA��B����
C��2mol��������4mol�Ҵ���������������Ӧ����������ӦΪ���淴Ӧ���������ɵ�������������С��2NA��C����
D��1mol�������Ǻ���5mol�ǻ���1molȩ����1Llmol/L����������Һ�����������ǵ����ʵ���Ϊ5mol�������ǻ��ĸ���Ϊ5NA��D��ȷ��
��ѡD��

����Ŀ������ˮ���ᣨ��˾ƥ�֣���Ŀǰ����ҩ��֮һ��ʵ����ͨ��ˮ��������������Ʊ���˾ƥ�ֵ�һ�ַ������£�

ˮ���� | ������ | ����ˮ���� | |
�۵�/�� | 157~159 | -72~-74 | 135~138 |
����ܶ�/��g��cm��3�� | 1.44 | 1.10 | 1.35 |
��Է������� | 138 | 102 | 180 |
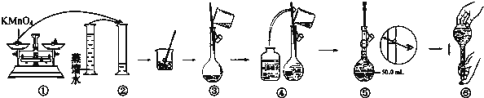
ʵ����̣���100 mL��ƿ�м���ˮ����6.9 g��������10 mL�����ҡ��ʹ������ȫ�ܽ⡣�����μ�0.5 mLŨ�������ȣ�ά��ƿ���¶���70 �����ң���ַ�Ӧ�������������²���.
���ڲ��Ͻ����½���Ӧ��Ļ���ﵹ��100 mL��ˮ�У��������壬���ˡ�
�����ýᾧ��Ʒ����50 mL����̼��������Һ���ܽ⡢���ˡ�
����Һ��Ũ�����ữ����ȴ�����˵ù��塣
�ܹ��徭�����ð�ɫ������ˮ���ᾧ��5.4 g��
�ش��������⣺
��1���úϳɷ�Ӧ��Ӧ����__________���ȡ������ţ�
A����ˮԡ B���ƾ��� C��ú���� D����¯
��2�����в��������У�������ʹ�õ���________�����ţ�������ʹ�õ�_______________________�������ƣ���

��3��������ʹ����ˮ��Ŀ����______________________________________��
��4�����б���̼�����Ƶ�������_________________________________���Ա���˳�ȥ�������ʡ�
��5���ܲ��õĴ�������Ϊ____________��
��6����ʵ��IJ�����_________%��