题目内容
2.有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是( )| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
分析 丁烷具有还原性,为原电池的负极,被氧化,电极反应式为C4H10+13O2--26e-=4CO2+5H2O,通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,总反应式为2C4H10+13O2→8CO2+10H2O,用该燃料电池和惰性电极电解Na2SO4溶液,相当于电解水在阴极氢离子得电子生成氢气,阳极氢氧根失电子生成氧气,以此解答该题,注意电解质和离子的定向移动方向.
解答 解:A、原电池中阴离子向负极移动,阳离子向正极移动,所以在熔融电解质中,O2-移向负极,故A正确;
B、用该燃料电池和惰性电极电解Na2SO4溶液,相当于电解水在阴极氢离子得电子生成氢气,阳极氢氧根失电子生成氧气,总反应为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,则电解一共生成0.9mol气体时,即生成0.6mol氢气,0.3mol氧气,所以转移电子的物质的量为0.6×2=1.2mol,又丁烷具有还原性,为原电池的负极,被氧化,电极反应式为C4H10+13O2--26e-=4CO2+5H2O,所以消耗$\frac{1}{26}$×1.2=0.046mol,故B错误;
C、电解池的阳极反应式为氢氧根失电子生成氧气,电极反应为:4OH--4e-═2H2O+O2↑,故C正确;
D、通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,故D正确;
故选B.
点评 本题考查原电池、电解池知识,题目难度中等,注意电解质溶液为非水物质,此为解题的关键.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
15.下列物质的使用不涉及化学变化的是( )
| A. | 制取粗硅 | B. | 用生石灰干燥氨气 | ||
| C. | 浓氨作制冷剂 | D. | 实验室中用棕色试剂瓶装浓HNO3 |
13.为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验,其中操作顺序合理的是( )
①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用HNO3酸化溶液.
①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用HNO3酸化溶液.
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
7.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
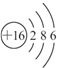
(2)画出⑨元素的原子结构示意图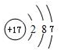 .②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.
.②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.
(3)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(4)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度Na>Mg>Al(写出一种).
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)画出⑨元素的原子结构示意图
 .②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.
.②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.(3)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(4)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度Na>Mg>Al(写出一种).
14.下列有关实验原理、方法和结论都正确的是( )
| A. | 实验室配置氯化铁溶液,将氯化铁固体溶于水,加盐酸抑制水解 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
11.下列各组元素中,第一电离能依次减小的是( )
| A. | H Li Na K | B. | Na Mg Al Cl | C. | I Br Cl F | D. | F O N C |
12.G.X.Y.Z.Q均为氯(Cl)的含氧化合物,它们有如下关系:
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
 .
.