题目内容
10.X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价.回答下列问题:(1)元素X原子结构示意图为
 .
.(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是146C.
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子总数是10,与该离子电子总数相等的Z与氢形成的微粒是NH3、NH4+.
(4)ZW3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为NCl3+4H2O═3HClO+NH3•H2O.
(5)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(用酸的分子式表示).
分析 X原子M层上的电子数是原子核外电子层数的2倍,说明X共有3个电子层,且M层上有6个电子,故X为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z元素的单质为双原子分子,Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素,据此解答.
解答 解:X原子M层上的电子数是原子核外电子层数的2倍,说明X共有3个电子层,且M层上有6个电子,故X为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z元素的单质为双原子分子,Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素.
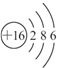
(1)X原子M层上的电子数是原子核外电子层数的2倍,说明X共有3个电子层,且M层上有6个电子,X为硫元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)碳的放射性同位素146C可用于考古,故答案为:146C;
(3)氮元素与氢元素形成-1价阴离子,由于氮元素显示-3价,氢元素显+1价,因此该阴离子为NH2-,其电子总数是10,与该离子电子数相等的还有NH3、NH4+,故答案为:10;NH3、NH4+;
(4)NCl3与H2O反应生成物中有碱,只能是NH3•H2O,N为-3价,Cl为+1价,酸应为HClO,反应方程式为:NCl3+4H2O═3HClO+NH3•H2O,
故答案为:NCl3+4H2O═3HClO+NH3•H2O;
(6)H2CO3、HNO3、H2SO4、HClO4中化学性质明显不同于其他三种酸的是H2CO3,H2CO3为弱酸,其它三种为强酸,故答案为:H2CO3.
点评 本题考查结构位置性质关系的应用,推断元素是解题关键,题目设置侧重对学生综合能力的考查,难度中等.

| A. | 对苯二甲酸 | B. | 丙酸 | C. | 乙二醇 | D. | 乙酸 |
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
①SO2 的物质的量不再变化
②O2 的浓度不再变化
③容器内气体压强不再变化
④混合气体的密度不再变化
⑤SO2 的生成速率和SO2 的分解速率相等
⑥SO2 的生成速率和O2 的消耗速率相等
⑦SO3的生成速率和SO3的分解速率相等
⑧混合气体的平均相对分子质量不再变化.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
| A. | 饱和NaCl溶液 | B. | AgNO3 | C. | CuCl2 | D. | 饱和NaOH溶液 |
 Mn、Fe均为第四周期过渡元素.请回答下列问题:
Mn、Fe均为第四周期过渡元素.请回答下列问题:
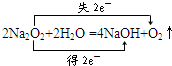 ,所以
,所以