题目内容
【题目】下列叙述中正确的是( )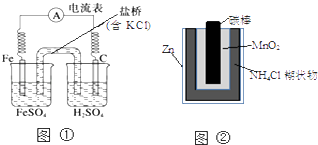
A.图①中正极附近溶液pH降低
B.图②正极反应是2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C.图①中电子由Fe流向石墨,盐桥中的Cl﹣移向FeSO4溶液
D.Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
【答案】C
【解析】解:A、正极的电极反应式为:2H++2e﹣=H2↑,氢离子浓度减小,附近溶液pH增大,故A错误;
B、正极材料为MnO2 , 发生还原反应,电极反应式为2MnO2+2NH4++2e﹣═Mn2O3+2NH3+H2O,故B错误;
C、电子由负极流向正极,所以电子由Fe流向石墨,阴离子向负极移动,即FeSO4溶液,故C正确;
D、该原电池中锌作负极,二氧化锰作正极,正极上得电子发生还原反应,所以Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的还原作用引起的,故D错误;
故选C.

练习册系列答案
相关题目