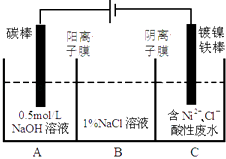
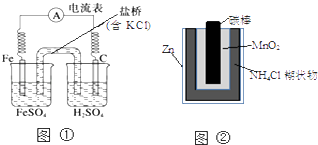
题目内容
【题目】将硫酸铜饱和溶液中加入无水硫酸铜,充分搅拌后,则( )
A.硫酸铜晶体溶解过程停止B.硫酸铜晶体结晶过程停止
C.硫酸铜晶体结晶速率等于溶解速率D.硫酸铜溶液变为不饱和溶液
【答案】C
【解析】
A. 硫酸铜晶体溶解过程是一个可逆过程,不会停止,A不正确;
B. 硫酸铜晶体结晶过程是一个可逆客,不会停止,B不正确;
C. 将硫酸铜饱和溶液中加入无水硫酸铜,最终硫酸铜晶体结晶速率等于溶解速率,正确;
D. 温度不变时,硫酸铜饱和溶液中加入无水硫酸铜,硫酸铜溶液不可能变为不饱和溶液,错误。
答案是C。

【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
【题目】甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质.上述物质转化关系如图所示(某些产物略去).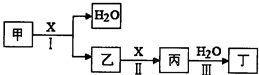
请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径.
①写出反应I的化学方程式:
②常温下,1mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: .
③在常温下,向VIL pH=11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是:(写一种即可).
(2)若丁是二元弱酸,丙是温室气体.
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反
应:乙(g)+H2O(g)丙(g)+H2(g),得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
乙 | H2O | 丙 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | 2 | 1 | 0.4 | 1 |
①该反应的正反应为(填“吸热”或“放热”)反应.
②900℃时,上述反应按如下起始量分别加入该容器:
物质 | 乙 | H2O | 丙 | H2 |
起始量/mol | 0.8 | 1.0 | 0.6 | 0.8 |
则此时反应的v(正) v(逆)(填“>”、“<”或“=”).
③实验3跟实验2相比,改变的条件可能是 .