题目内容
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
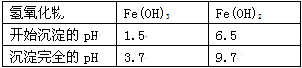
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72–的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
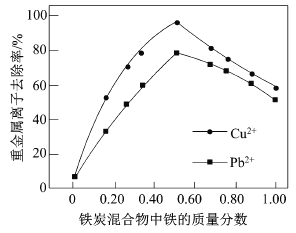
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4–(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3–+10H+===4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
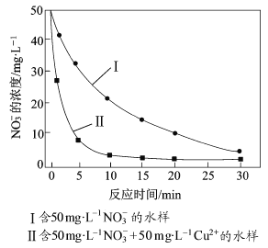
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见图),产生该差异的可能原因是 。
【答案】(1)Cr2O72–+6e-+14H+===2Cr3++7H2O (2)①活性炭对Cu2+和Pb2+有吸附作用
②铁的质量分数增加,铁炭混合物中微电池数目减少
(3)①2Fe2++BH4-+4OH-===2Fe+ B(OH)4-+2H2↑ ②纳米铁粉与H+反应生成H2
③Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)
【解析】
试题分析:(1)混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–获得电子,被还原产生Cr3+,则正极上发生的电极反应式为Cr2O72–+6e-+14H+===2Cr3++7H2O;
(2)①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,原因是活性炭是疏松多孔的物质,表面积大,吸附力强,可以吸附水中少量的Cu2+和Pb2+,从而可以降低水中Cu2+和Pb2+的浓度;
②铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,铁炭混合物中微电池数目减少,因此Cu2+和Pb2+的去除率不升反降;
(3)①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4–(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为2Fe2++BH4-+4OH-===2Fe+ B(OH)4-+2H2↑;
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+ NO3-+10H+===4Fe2++NH4++3H2O,若pH偏低,则溶液的酸性增强,会发生反应:Fe+2H+===Fe2++ H2↑;导致NO3-的去除率下降;
③根据图像可知,相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,可能是由于Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
, ![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
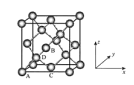
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a="565.76" pm,其密度为__________g·cm-3(列出计算式即可)。