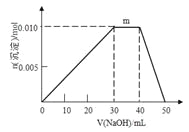
��Ŀ����
����Ŀ����.���º�����2 mol A�����2 mol B����ͨ�����Ϊ2 L���ܱ������з������·�Ӧ��2A(g)��B(g)![]() xC(g)��2D(s)��2 min ʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2 mol B�������C��Ũ��Ϊ1.2 mol/L��
xC(g)��2D(s)��2 min ʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2 mol B�������C��Ũ��Ϊ1.2 mol/L��
��1���ӿ�ʼ��Ӧ���ﵽƽ��״̬��A��ת����Ϊ________��
��2��x��________��
��3�����и������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����________(��������)
A��ѹǿ���ٱ仯
B������ƽ����Է����������ٱ仯
C�������ܶȲ��ٱ仯
D��A������������B����������֮��Ϊ2:1
��.һ�������£����淴ӦA2(g)+B2(g) ![]() 2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊc(A2)=0.4mol��L��1��c(B2)=0.1mol��L��1��c(C)=1.6mol��L��1��
2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊc(A2)=0.4mol��L��1��c(B2)=0.1mol��L��1��c(C)=1.6mol��L��1��
��1������Ӧ��ʼʱ����Ӧ������δ����B��10s��ﵽƽ�⣬��10s����C��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ_____________��
��2����A2��B2��C�ij�ʼŨ�ȷֱ���a��b��c��ʾ(mol��L��1)����a��bӦ����Ĺ�ϵ�� ��a��ȡֵ��Χ�� ��
���𰸡�
����1��80%��
��2��3��
��3��BC
����1��0.02 mol/(L��s)
��2��a-b=0.3�� 0.3�Qa�Q1.2
��������
���������������1��2A(g)+B(g)![]() xC(g)+2D(s)��
xC(g)+2D(s)��
��ʼ 2 2 0 0
ת�� 1.6 0.8
ƽ�� 0.4 1.2
��A��ת����Ϊ![]() ��100%=80%���ʴ�Ϊ��80%��
��100%=80%���ʴ�Ϊ��80%��
��2��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B����B�ķ�Ӧ����Ϊ =0.2mol/(L��min)���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪��x=3���ʴ�Ϊ��3��
=0.2mol/(L��min)���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪��x=3���ʴ�Ϊ��3��
��3��2A(g)+B(g)![]() 3C(g)+2D(s)��A���÷�Ӧ��ѹǿʼ�ղ��䣬�����ж�ƽ�⣬��A����B��������������ڱ仯���������ܶȲ��ٱ仯���ﵽƽ�⣬��B��ȷ��C��������������ڱ仯���������ƽ����Է����������ٱ仯���ﵽƽ�⣬��C��ȷ��D��A������������B����������֮��Ϊ2:1����ϵʼ�մ��ڣ������ж�ƽ�⣬��D���ʴ�Ϊ��BC��
3C(g)+2D(s)��A���÷�Ӧ��ѹǿʼ�ղ��䣬�����ж�ƽ�⣬��A����B��������������ڱ仯���������ܶȲ��ٱ仯���ﵽƽ�⣬��B��ȷ��C��������������ڱ仯���������ƽ����Է����������ٱ仯���ﵽƽ�⣬��C��ȷ��D��A������������B����������֮��Ϊ2:1����ϵʼ�մ��ڣ������ж�ƽ�⣬��D���ʴ�Ϊ��BC��
������1��10s����c(B2)=0.1molL-1��v(B2)=![]() =0.01molL-1s-1��v(C)=2v(B2)=2��0.01molL-1s-1=0.02 molL-1s-1���ʴ�Ϊ��0.02 molL-1s-1��
=0.01molL-1s-1��v(C)=2v(B2)=2��0.01molL-1s-1=0.02 molL-1s-1���ʴ�Ϊ��0.02 molL-1s-1��
��2��A2(g)+B2(g)![]() 2C(g)���μӷ�Ӧ��A2��B2��Ũ����ͬ���ʶ���ƽ��Ũ��֮��Ӧ������ʼŨ��֮���a-b=0.4-0.1=0.3����ƽ�������������
2C(g)���μӷ�Ӧ��A2��B2��Ũ����ͬ���ʶ���ƽ��Ũ��֮��Ӧ������ʼŨ��֮���a-b=0.4-0.1=0.3����ƽ�������������
A2(g)+B2(g)![]() 2C(g)
2C(g)
��ʼ�� a b 0
ת����a-0.4 b-0.1 1.6
ƽ�⣺ 0.4 0.1 1.6
![]() =
=![]() ��a=1.2mol/L��
��a=1.2mol/L��
��ƽ�������������
A2(g)+B2(g)![]() 2C(g)
2C(g)
��ʼ�� a 0 c
ת����0.1 0.1
ƽ�⣺0.4 0.1 1.6
a+0.1=0.4��a=0.3mol/L����a��ȡֵ��ΧΪ��0.3��a��1.2���ʴ�Ϊ��a-b=0.3��0.3��a��1.2