题目内容
【题目】本题有三小题。
(1)已知N2,CO,H2O,NH3,CO2均为高中化学常见的分子,根据要求回答有关问题:
①根据等电子体原理,写出CO分子的结构式___________。
②试比较两分子中的键角大小:H2O___________NH3,(填“>”、“=”或“<” )
③基态N原子核外电子有 种不同的运动状态, B、C、N、O的第一电离能由大到小的顺序为 .
(2)科学家合成了Si60、N60, Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则28 g Si60分子中π键的数目为 。
(3)①立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。
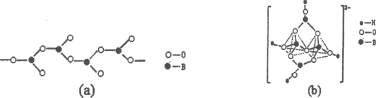
②在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(4) “嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为 .
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 .
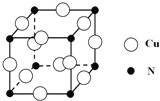
③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
【答案】
(1)①![]() ;②<; ③7 , N>O>C>B ;
;②<; ③7 , N>O>C>B ;
(2)0.5 NA;
(3)① B-N键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;
②BO2-或[BO2]nn-- ;sp2、sp3 ;
(4)①平面三角形;②Cu+H2O2+4NH3H2O=Cu(NH3)42++2 OH-﹣+4H2O; ③![]() ×1030gcm﹣3
×1030gcm﹣3
【解析】
试题分析:(1)①CO和N2互为等电子体,CO和N2的结构相似,所以CO分子中含有三键,电子式为:![]() ,答案为:
,答案为:![]() ;②水和氨分子中的中心原子O原子和氮原子都是sp3杂化,但是时水分子中的孤对电子为2,氨分子中的孤对电子为1,孤电子间的排斥力大于成键电子间的排斥力,所以键角H2O<NH3,答案为:H2O<NH3;③氮元素是7号元素,核外有7个电子,所以N原子核外有7种不同运动状态的电子,B、C、N、O的第一电离能由大到小的顺序为:>O>C>B,答案为:N>O>C>B;(2)每个Si原子可以形成4个共价键,但Si60分子中每个Si原子只跟3个硅原子形成共价键,说明其中一个形成硅硅双键,每个硅原子形成1/2个双键,双键中有一个是σ,另一个是π键,所以1molSi60分子中的π键数目为0.5NA,答案为:0.5NA;(3)①立方氮化硼结构和硬度都与金刚石相似,氮化硼属于原子晶体,但熔点比金刚石低,原因是氮化硼中氮硼共价键的长度比金刚石中碳碳键的键长长,导致氮化硼中氮硼键的键能小于金刚石,所以熔点比金刚石低,答案为:B-N键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;②根据硼酸盐中阴离子的结构可以看出每一个B原子周围有3个氧原子,其中2个是和另外2个阴离子共用,所以阴离子的符号为BO2-或[BO2]nn-- ,答案为:BO2-或[BO2]nn-- ;③一个该合金的晶胞中铜原子的个数为12×1/4=3,氮原子的个数为:8×1/8=1,该晶胞的质量为:(3×64+14)/NA,体积为
;②水和氨分子中的中心原子O原子和氮原子都是sp3杂化,但是时水分子中的孤对电子为2,氨分子中的孤对电子为1,孤电子间的排斥力大于成键电子间的排斥力,所以键角H2O<NH3,答案为:H2O<NH3;③氮元素是7号元素,核外有7个电子,所以N原子核外有7种不同运动状态的电子,B、C、N、O的第一电离能由大到小的顺序为:>O>C>B,答案为:N>O>C>B;(2)每个Si原子可以形成4个共价键,但Si60分子中每个Si原子只跟3个硅原子形成共价键,说明其中一个形成硅硅双键,每个硅原子形成1/2个双键,双键中有一个是σ,另一个是π键,所以1molSi60分子中的π键数目为0.5NA,答案为:0.5NA;(3)①立方氮化硼结构和硬度都与金刚石相似,氮化硼属于原子晶体,但熔点比金刚石低,原因是氮化硼中氮硼共价键的长度比金刚石中碳碳键的键长长,导致氮化硼中氮硼键的键能小于金刚石,所以熔点比金刚石低,答案为:B-N键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;②根据硼酸盐中阴离子的结构可以看出每一个B原子周围有3个氧原子,其中2个是和另外2个阴离子共用,所以阴离子的符号为BO2-或[BO2]nn-- ,答案为:BO2-或[BO2]nn-- ;③一个该合金的晶胞中铜原子的个数为12×1/4=3,氮原子的个数为:8×1/8=1,该晶胞的质量为:(3×64+14)/NA,体积为![]() ,所以该晶胞的密度为:
,所以该晶胞的密度为:![]() ×1030gcm﹣3,答案为:
×1030gcm﹣3,答案为:![]() ×1030gcm﹣3;
×1030gcm﹣3;

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案