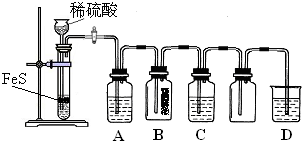
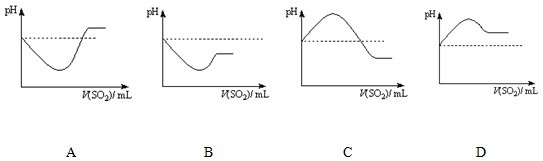
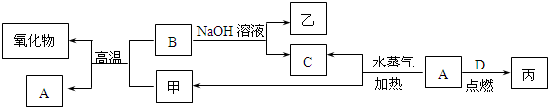
题目内容
常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )A.pH>7,且C(OH-)>C(Na+)>C(H+)>C(CH3COO-)
B.pH>7,且C(Na+)+C(H+)=C(OH-)+C(CH3COO-)
C.pH<7,且C(CH3COO-)>C(H+)>C(Na+)>C(OH-)
D.pH=7,且C(CH3COO-)>C(Na+)>C(H+)=C(OH-)
AD
解析:NaOH与CH3COOH混合,则二者可能恰好反应或酸碱过量 ,但不论哪种情况,总是c(CH3COO-)>c(H+),A不正确;根据电荷守恒知c(Na+)+c(H+)=c(OH-)+c(CH3COO-),B正确;若pH<7,则酸过量,在一定条件下(CH3COOH过量较多)可使C选项成立;若pH=7,则c(H+)=c(OH-),根据电荷守恒可推得c(CH3COO-)=c(Na+),D不成立,故本题答案为A、D。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是( )
| A、溶液中c(CO32-):c(HCO3-)<1:2 | B、溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 | D、将混合液蒸干,水解加剧,最终得NaOH固体 |