题目内容
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:
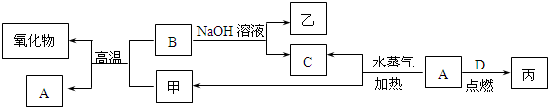
请回答下列问题:
(1)B与甲反应的化学方程式是
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
mol,混合物中A的质量为
×56
×56g(用含字母的分数式表示).
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为

请回答下列问题:
(1)B与甲反应的化学方程式是
3Fe3O4+8Al
9Fe+4Al2O3
| ||
3Fe3O4+8Al
9Fe+4Al2O3
.
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
否
否
(填“是”或“否”).(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
.(4)写出A与水蒸气反应生成C和甲的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,混合物中B的物质的量为| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
30%
30%
.分析:A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质,结合转化关系可知,甲为四氧化三铁,B为Al,A为Fe,C为氢气,乙为偏铝酸钠,丙为氯化铁,然后结合元素化合物知识及化学用语来解答.
解答:解:A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质,结合转化关系可知,甲为四氧化三铁,B为Al,A为Fe,C为氢气,乙为偏铝酸钠,丙为氯化铁,
(1)B与甲反应的化学方程式为3Fe3O4+8Al
9Fe+4Al2O3,故答案为:3Fe3O4+8Al
9Fe+4Al2O3;
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中发生钝化,不能完全溶解,故答案为:否;
(3)检验铁离子的方法为取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+;
(4)A与水蒸气反应生成C和甲的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(5)①B与NaOH溶液反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,生成气体的体积在标准状况下为n L,n(H2)=
mol,则n(Al)=
mol×
=
mol,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
;
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,转移电子为
×2×(1-0)=
mol,混合物中A的质量为x,由电子守恒可知,
mol×3+
mol×2=
×2×(1-0),解得x=
×56,故答案为:
;
×56;
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,固体为氧化铁,则氧的质量等于Al的质量,所以Al的质量分数等于氧化铁中氧的质量分数,为
×100%=30%,故答案为:30%.
(1)B与甲反应的化学方程式为3Fe3O4+8Al
| ||
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中发生钝化,不能完全溶解,故答案为:否;
(3)检验铁离子的方法为取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+;
(4)A与水蒸气反应生成C和甲的化学方程式为3Fe+4H2O(g)
| ||
| ||
(5)①B与NaOH溶液反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,生成气体的体积在标准状况下为n L,n(H2)=
| n |
| 22.4 |
| n |
| 22.4 |
| 2 |
| 3 |
| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,转移电子为
| m |
| 22.4 |
| m |
| 11.2 |
| n |
| 33.6 |
| x |
| 56 |
| m |
| 22.4 |
| m-n |
| 22.4 |
| m |
| 11.2 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,固体为氧化铁,则氧的质量等于Al的质量,所以Al的质量分数等于氧化铁中氧的质量分数,为
| 16×3 |
| 160 |
点评:本题考查无机物的推断,注意铝热反应及D为黄绿色气体为解答本题的突破口,物质的推断是解答本题的关键,本题中的计算主要涉及电子守恒及关系式,题目难度中等.

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为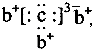 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为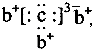 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 Al(OH)3+OH-
Al(OH)3+OH-