��Ŀ����
ˮ��Һ����ѧ��ѧ���ص��о�����
��1��ˮ�Ǽ����ĵ���ʣ�Ҳ������Ҫ���ܼ���������ij������ܽ���ˮ�к���Һ�е�c��H+��=10-9mol?L-1����õ���ʿ�����
A�� CuSO4 B�� HCl C�� Na2S D��NaOH E��K2SO4
��2����֪�������DZ�̼�ỹ�����ᣬҪʹ����ϡ��ˮ�е�c��HClO�������Բ�ȡ�Ĵ�ʩΪ�����ٻش����֣�
��3�������£���pH=3������a L�ֱ�������������Һ��ϣ������Һ�������ԣ�
��Ũ��Ϊ1.0��10-3mol?L-1�İ�ˮb L����c��OH-��=1.0��10-3mol?L-1�İ�ˮc L����c��OH-��=1.0��10-3mol?L-1������������Һd L����a��b��c��d֮��Ĺ�ϵ�ǣ�
��4��ǿ����������ˮ��Һ�е���Ҫ������ɣ�
����֪HA��H2B���������ᣬ�������¹�ϵ��H2B��������+2A-=B2-+2HA����A-��B2-��HB-���������ӽ��H+������˳��Ϊ
��ijͬѧ��H2Sͨ��CuSO4��Һ�з������ɺ�ɫ�������������ϲ�����ʦ��ָ����д���˻�ѧ����ʽ��H2S+CuSO4=CuS��+H2SO4������λͬѧ�����������ⲻ����������ȡǿ�����������������
��5����֪��H2A�TH++HA-��HA-?H++A2-�������£�0.1mol?L-1��NaH A��Һ��pH=2����0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ�ǣ�
��6����֪��Ksp��AgCl��=1.8��10-10mol?L-1����50mL 0.018mol?L-1��AgNO3��Һ�м�����ͬ���0.020mol?L-1�����ᣬ��c��Ag+��=
��1��ˮ�Ǽ����ĵ���ʣ�Ҳ������Ҫ���ܼ���������ij������ܽ���ˮ�к���Һ�е�c��H+��=10-9mol?L-1����õ���ʿ�����
CD
CD
������ţ���A�� CuSO4 B�� HCl C�� Na2S D��NaOH E��K2SO4
��2����֪�������DZ�̼�ỹ�����ᣬҪʹ����ϡ��ˮ�е�c��HClO�������Բ�ȡ�Ĵ�ʩΪ�����ٻش����֣�
��ͨ������������̼���Ρ������������
��ͨ������������̼���Ρ������������
����3�������£���pH=3������a L�ֱ�������������Һ��ϣ������Һ�������ԣ�
��Ũ��Ϊ1.0��10-3mol?L-1�İ�ˮb L����c��OH-��=1.0��10-3mol?L-1�İ�ˮc L����c��OH-��=1.0��10-3mol?L-1������������Һd L����a��b��c��d֮��Ĺ�ϵ�ǣ�
b��a=d��c
b��a=d��c
����4��ǿ����������ˮ��Һ�е���Ҫ������ɣ�
����֪HA��H2B���������ᣬ�������¹�ϵ��H2B��������+2A-=B2-+2HA����A-��B2-��HB-���������ӽ��H+������˳��Ϊ
A-��B2-��HB-
A-��B2-��HB-
����ijͬѧ��H2Sͨ��CuSO4��Һ�з������ɺ�ɫ�������������ϲ�����ʦ��ָ����д���˻�ѧ����ʽ��H2S+CuSO4=CuS��+H2SO4������λͬѧ�����������ⲻ����������ȡǿ�����������������
ͭ���Ӻ�����ֻ������������ͭ����������Ϊ��ͭ��������ˮ����������
ͭ���Ӻ�����ֻ������������ͭ����������Ϊ��ͭ��������ˮ����������
����5����֪��H2A�TH++HA-��HA-?H++A2-�������£�0.1mol?L-1��NaH A��Һ��pH=2����0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ�ǣ�
0.1mol/L��c��H+����0.11mol/L
0.1mol/L��c��H+����0.11mol/L
��NaHA��Һ�и�������Ũ�ȴ�С��ϵΪc��Na+����c��HA-����c��H+����c��A2-����c��OH-��
c��Na+����c��HA-����c��H+����c��A2-����c��OH-��
����6����֪��Ksp��AgCl��=1.8��10-10mol?L-1����50mL 0.018mol?L-1��AgNO3��Һ�м�����ͬ���0.020mol?L-1�����ᣬ��c��Ag+��=
1.8��10-7mol/L
1.8��10-7mol/L
����ʱ���û����Һ��pH=2
2
����������1�������£���ˮ��c��H+��=10-7mol?L-1������ij���ʺ���Һ��c��H+��=10-9mol?L-1��˵����Һ�ʼ��ԣ����������ʵ�ˮ��Һ�ʼ��ԣ�
��2����ˮ�д��ڵ�ƽ����Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-��Ҫʹc��HClO��������ijЩ����ʹCl2+H2O?H++Cl-+HClO��ƽ��������Ӧ�����ƶ���ʹHClO?H++ClO-��ƽ�����淴Ӧ�����ƶ���
��3��һˮ�ϰ�Ϊ������ʣ�������ȫ���룬pH��ͬʱ����ˮŨ�����
��4���ٸ��ݷ�ӦH2B��������+2A-=B2-+2HA����֪��HA����С��H2B��HA��������������Խ������Ӧ��������ӵ�H+����Խǿ��
��ͭ���Ӻ�����ֻ������������ͭ��������ͭ��������ˮ���������
��5��H2A=H++HA-��HA-?H++A2-��֪����һ����ȫ���룬�ڶ�������ȫ���룬���0.1mol?L-1NaHA��Һ��pH=2ȷ��0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ��0.1mol?L-1NaHA��Һ��pH=2����HA-�ĵ��������ˮ�⣬�ٽ��ˮ�⡢��������֪ʶ�����
��6�����ݻ����Һ�������ӵ�Ũ�Ƚ���ܶȻ���������������Ũ�ȣ�����������Ũ�ȼ�����Һ��pH��
��2����ˮ�д��ڵ�ƽ����Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-��Ҫʹc��HClO��������ijЩ����ʹCl2+H2O?H++Cl-+HClO��ƽ��������Ӧ�����ƶ���ʹHClO?H++ClO-��ƽ�����淴Ӧ�����ƶ���
��3��һˮ�ϰ�Ϊ������ʣ�������ȫ���룬pH��ͬʱ����ˮŨ�����
��4���ٸ��ݷ�ӦH2B��������+2A-=B2-+2HA����֪��HA����С��H2B��HA��������������Խ������Ӧ��������ӵ�H+����Խǿ��
��ͭ���Ӻ�����ֻ������������ͭ��������ͭ��������ˮ���������
��5��H2A=H++HA-��HA-?H++A2-��֪����һ����ȫ���룬�ڶ�������ȫ���룬���0.1mol?L-1NaHA��Һ��pH=2ȷ��0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ��0.1mol?L-1NaHA��Һ��pH=2����HA-�ĵ��������ˮ�⣬�ٽ��ˮ�⡢��������֪ʶ�����
��6�����ݻ����Һ�������ӵ�Ũ�Ƚ���ܶȻ���������������Ũ�ȣ�����������Ũ�ȼ�����Һ��pH��
����⣺��1�������£���ˮ��c��H+��=10-7mol?L-1������ij���ʺ���Һ��c��H+��=10-9mol?L-1��˵����Һ�ʼ��ԣ������������Ǽ��ǿ�������Σ���ѡCD��
��2����ˮ�д��ڵ�ƽ����Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-��Ҫʹc��HClO��������ijЩ����ʹCl2+H2O?H++Cl-+HClO��ƽ��������Ӧ�����ƶ���ʹHClO?H++ClO-��ƽ�����淴Ӧ�����ƶ������Կ���ͨ�����������̼���λ����������Σ��ʴ�Ϊ����ͨ������������̼���Ρ�����������ƣ�
��3��һˮ�ϰ�Ϊ������ʣ�������ȫ���룬�����ᷴӦ������ʱ����ˮӦ�Թ�������b��a��c��OH-��=1.0��10-3mol?L-1�İ�ˮ��һˮ�ϰ�Ũ��Զ����1.0��10-3mol��L-l�İ�ˮ����Ӧ������ʱ��a��c����������Ϊǿ���������ȫ�к�ʱ��a=d����b��a=d��c���ʴ�Ϊ��b��a=d��c��
��4���پݷ�ӦH2B��������+2A-=B2-+2HA����֪��HA����С��H2B��HA��������������Խ������Ӧ��������ӵ�H+����Խǿ��û��HB-���ɣ�˵���õ�������A-����HB-����õ�������˳��ΪA-��B2-��HB-���ʴ�Ϊ��A-��B2-��HB-��
��ͭ���Ӻ�����ֻ������������ͭ��������ͭ��������ˮ���������ᣬ�������������ͭ�ܷ�Ӧ��
�ʴ�Ϊ��ͭ���Ӻ�����ֻ������������ͭ����������Ϊ��ͭ��������ˮ���������
��5��H2A=H++HA-��HA-?H++A2-��֪����һ����ȫ���룬�ڶ�������ȫ���룬0.1mol?L-1��H2A��Һ��H2A��һ�������������Ũ����0.1mol/L��0.1mol?L-1��NaH A��Һ��pH=2��˵��HA-�����ˮ����0.01mol/L��HA-�ĵ�����������Ե����������Ũ��С��0.01mol/L����0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ��0.1mol/L��c��H+����0.11mol/L��NaHA��Һ��HA-�ĵ��������ˮ�⣬������Ũ�ȵĹ�ϵ��c��Na+����c��HA-����c��H+����c��A2-����c��OH-����
�ʴ�Ϊ��0.1mol/L��c��H+����0.11mol/L��c��Na+����c��HA-����c��H+����c��A2-����c��OH-����
��6���������������Ӧ�����ʵ���֮����1��1��n��AgNO3��=0.05L��0.018mol?L-1=9��10-4 mol��n��HCl��=0.05L��0.020mol?L-1=1��10-3 mol��n��AgNO3����n��HCl������������ʣ�࣬�����Һ��C��Cl-��=c��HCl��=
=10-3 mol/L��c��Ag+��=
=
mol/L=1.8��10-7 mol/L��c��H+��=0.01mol/L��pH=2��
�ʴ�Ϊ��1.8��10-7mol/L��2��
��2����ˮ�д��ڵ�ƽ����Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-��Ҫʹc��HClO��������ijЩ����ʹCl2+H2O?H++Cl-+HClO��ƽ��������Ӧ�����ƶ���ʹHClO?H++ClO-��ƽ�����淴Ӧ�����ƶ������Կ���ͨ�����������̼���λ����������Σ��ʴ�Ϊ����ͨ������������̼���Ρ�����������ƣ�
��3��һˮ�ϰ�Ϊ������ʣ�������ȫ���룬�����ᷴӦ������ʱ����ˮӦ�Թ�������b��a��c��OH-��=1.0��10-3mol?L-1�İ�ˮ��һˮ�ϰ�Ũ��Զ����1.0��10-3mol��L-l�İ�ˮ����Ӧ������ʱ��a��c����������Ϊǿ���������ȫ�к�ʱ��a=d����b��a=d��c���ʴ�Ϊ��b��a=d��c��
��4���پݷ�ӦH2B��������+2A-=B2-+2HA����֪��HA����С��H2B��HA��������������Խ������Ӧ��������ӵ�H+����Խǿ��û��HB-���ɣ�˵���õ�������A-����HB-����õ�������˳��ΪA-��B2-��HB-���ʴ�Ϊ��A-��B2-��HB-��
��ͭ���Ӻ�����ֻ������������ͭ��������ͭ��������ˮ���������ᣬ�������������ͭ�ܷ�Ӧ��
�ʴ�Ϊ��ͭ���Ӻ�����ֻ������������ͭ����������Ϊ��ͭ��������ˮ���������
��5��H2A=H++HA-��HA-?H++A2-��֪����һ����ȫ���룬�ڶ�������ȫ���룬0.1mol?L-1��H2A��Һ��H2A��һ�������������Ũ����0.1mol/L��0.1mol?L-1��NaH A��Һ��pH=2��˵��HA-�����ˮ����0.01mol/L��HA-�ĵ�����������Ե����������Ũ��С��0.01mol/L����0.1mol?L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ��0.1mol/L��c��H+����0.11mol/L��NaHA��Һ��HA-�ĵ��������ˮ�⣬������Ũ�ȵĹ�ϵ��c��Na+����c��HA-����c��H+����c��A2-����c��OH-����
�ʴ�Ϊ��0.1mol/L��c��H+����0.11mol/L��c��Na+����c��HA-����c��H+����c��A2-����c��OH-����
��6���������������Ӧ�����ʵ���֮����1��1��n��AgNO3��=0.05L��0.018mol?L-1=9��10-4 mol��n��HCl��=0.05L��0.020mol?L-1=1��10-3 mol��n��AgNO3����n��HCl������������ʣ�࣬�����Һ��C��Cl-��=c��HCl��=
| 1��10 -3mol-9��10-4mol |
| 0.1L |
| Ksp |
| C(Cl-) |
| 1.8��10-10 |
| 1��10-3 |
�ʴ�Ϊ��1.8��10-7mol/L��2��
���������⿼���Ϊ�ۺϣ���Ŀ�ѶȽϴ�ע�⣨4�����бȽ������ӽ��H+������˳���������Խ������������Խ��Һ��������ӣ�Ϊ�״��㣮

��ϰ��ϵ�д�
 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
�����Ŀ
 A��B��C��X����ѧ��ѧ1�г�����4�����ʣ����Ǿ��ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ������������������1�ش��������⣺
A��B��C��X����ѧ��ѧ1�г�����4�����ʣ����Ǿ��ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ������������������1�ش��������⣺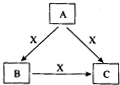 A��B��C��X����ѧ��ѧ�������ʣ�ת����ϵ��ͼ��ʾ����������²�ͬ����ش����⣺
A��B��C��X����ѧ��ѧ�������ʣ�ת����ϵ��ͼ��ʾ����������²�ͬ����ش����⣺ A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ����������²�ͬ����ش�
A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ����������²�ͬ����ش�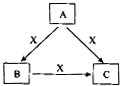 A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ��������������ֲ�ͬ����ش�
A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ��������������ֲ�ͬ����ش�
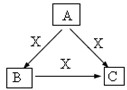 A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��������������ֲ�ͬ����ش�
A��B��C��X����ѧ��ѧ�������ʣ����ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��������������ֲ�ͬ����ش�