题目内容
(2013?海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
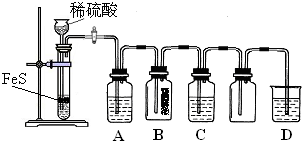
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
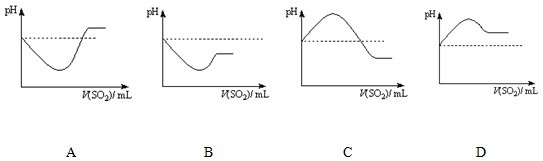
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
H2S+CuSO4=CuS↓+H2SO4
H2S+CuSO4=CuS↓+H2SO4
.②B中的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
.③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
H2S+2Fe3+=S↓+2H++2Fe2+
H2S+2Fe3+=S↓+2H++2Fe2+
.④D中盛放的试剂可以是
d
d
(填标号).a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
酸性(或酸性较强)
酸性(或酸性较强)
条件下,+4价硫的化合物可以氧化-2价硫的化合物.②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
C
C
(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
.分析:(1)①CuSO4与H2S反应生成CuS沉淀;
②H2S水溶液呈酸性;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+;
④H2S可与碱反应.
(2)①H2S与SO2发生氧化还原反应生成S;
②根据H2SO3 酸性比H2S强判断;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验.
②H2S水溶液呈酸性;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+;
④H2S可与碱反应.
(2)①H2S与SO2发生氧化还原反应生成S;
②根据H2SO3 酸性比H2S强判断;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验.
解答:解:(1)①CuSO4与H2S反应生成CuS沉淀,反应的方程式为H2S+CuSO4=CuS↓+H2SO4,故答案为:H2S+CuSO4=CuS↓+H2SO4;
②H2S水溶液呈酸性,可使湿润的蓝色石蕊试纸变红,故答案为:蓝色石蕊试纸变红;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+,反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+,故答案为:H2S+2Fe3+=S↓+2H++2Fe2+;
④H2S有毒,不能排放到空气中,可与碱反应,故答案为:d;
(2)①由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
②H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验,但应先将H2S除去,方法是将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应,
故答案为:将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
②H2S水溶液呈酸性,可使湿润的蓝色石蕊试纸变红,故答案为:蓝色石蕊试纸变红;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+,反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+,故答案为:H2S+2Fe3+=S↓+2H++2Fe2+;
④H2S有毒,不能排放到空气中,可与碱反应,故答案为:d;
(2)①由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
②H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验,但应先将H2S除去,方法是将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应,
故答案为:将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
点评:本题考查实验制备方案的设计,侧重于硫化氢的性质的设计,题目难度不大,注意把握实验原理和实验的基本操作方法的学习.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目