题目内容
17.下面的反应中,氨作为氧化剂参加反应的是( )| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
分析 做氧化剂,则该物质中的元素的化合价降低,以此来解答.
解答 解:A.反应中没有元素化合价的变化,不是氧化还原反应,故A不选;
B.反应中氨气的H元素的化合价降低,被还原,做氧化剂,故B选;
C.反应中氨气的N元素的化合价升高,被氧化,做还原剂,故C不选;
D.反应中氨气的N元素的化合价升高,被氧化,做还原剂,故D不选;
故选B.
点评 本题考查氧化还原反应,明确元素的化合价及化合物与性质的关系即可解答,题目难度不大.

练习册系列答案
相关题目
7.1L 2mol/L NaOH溶液中取出0.6L,剩下的溶液的浓度为( )
| A. | 2mol/L | B. | 1.2mol/L | C. | 0.8mol/L | D. | 无法确定 |
8.下列说法正确的是( )
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |
2.前一时期“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好.已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-.下列有关说法中正确的是( )
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
7.在一定条件下,向2L密闭容器中充入3mol X气体和1mol Y气体,发生下列反应:2X(气)+Y(气)?3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是( )
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |

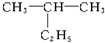 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.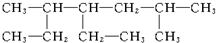 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.
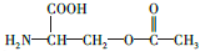 .
.
 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$ .
.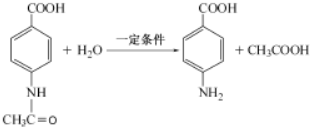 .
.