题目内容
2.前一时期“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好.已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-.下列有关说法中正确的是( )| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
分析 A.ClO2常温下呈气态,其分子构型与水分子的分子构型相似,均为极性分子;
B.作为消毒剂,具有强氧化性,最终可生成Cl-,结合化合价变化计算;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2.
解答 解:A.分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,属极性分子,故A错误;
B.作为消毒剂,具有强氧化性,最终可生成Cl-,1molClO2可得5mol电子,而1mol氯气得到2mol电子,其消毒效率(以单位体积得电子的数目)是氯气的2.5倍,故B错误;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物,不能广泛应用,应寻找替代品,故C错误;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2,方程式为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O,故D正确.
故选D.
点评 本题考查ClO2,为高频考点,侧重氧化还原反应基本概念及转移电子的考查,注意分析习题中的信息及知识迁移应用,题目难度不大.

练习册系列答案
相关题目
17.下面的反应中,氨作为氧化剂参加反应的是( )
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
14.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有组试剂的洗气瓶 …( )
| A. | 澄清石灰水、浓H2SO4 | B. | KMnO4(H+)、浓H2SO4 | ||
| C. | 溴水、NaOH溶液、浓H2SO4 | D. | 浓H2SO4、KMnO4(H+)、NaOH溶液 |
12.下列说法或有关化学用语的表达正确的是( )
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
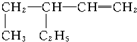 名称:3-乙基-1-戊烯.
名称:3-乙基-1-戊烯. 名称:5-甲基-2-己烯.
名称:5-甲基-2-己烯. 名称:5-甲基-3-庚炔.
名称:5-甲基-3-庚炔.
 .
. .
.