题目内容
5.味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染.请回答下列问题:(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为NH4++2O2=NO3-+2H++H2O.
(2)MAP沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4•6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法.
①用离子方程式表示反应的原理Mg2++NH4++PO43-+6H2O=MgNH4PO4•6H2O↓.
②MAP沉淀法需要控制反应的pH 在7.5~10之间.当pH>10时,由于溶液中铵根离子变成气态氨挥发,Mg2+会生成Mg(OH)2沉淀而不利于MAP的生成.
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用.对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA•cm-2下电解,180min内去除率达到98.22%.
①阳极发生的电极反应式是2Cl--2e-=C12↑;HClO氧化除去氨氮的反应离子方程式是2NH4++3HClO=N2+3H2O+5H++3Cl-.
②为了提高氨氮的去除率,需要控制溶液中Cl-的浓度和pH,根据如图判断:

Cl-的适宜浓度为8g•L-1,适宜的pH为8.
分析 (1)铵根能被氧气氧化为硝酸根、氢离子和水;
(2)①镁离子、铵根与磷酸根反应生成MgNH4PO4•6H2O;
②铵根离子能与氢氧根反应气态氨,Mg2+能与氢氧根反应生成Mg(OH)2沉淀;
(3)①电解时阳极氯离子先放电,次氯酸与铵根反应生成氮气和氢离子;
②pH>10时,溶液中铵根离子变成气态氨挥发,Cl-的浓度为8g/L、10g/L、12g/L对氨氮最后的去处率差不多,从节约成本角度考虑选用8g/L.
解答 解:(1)铵根能被氧气氧化为硝酸根、氢离子和水,离子方程式为:NH4++2O2=NO3-+2H++H2O,故答案为:NH4++2O2=NO3-+2H++H2O;
(2)①镁离子、铵根与磷酸根反应生成MgNH4PO4•6H2O,离子方程式为:Mg2++NH4++PO43-+6H2O=MgNH4PO4•6H2O↓,故答案为:Mg2++NH4++PO43-+6H2O=MgNH4PO4•6H2O↓;
②铵根离子能与氢氧根反应气态氨挥发,Mg2+能与氢氧根反应生成Mg(OH)2沉淀,故答案为:溶液中铵根离子变成气态氨挥发,Mg2+会生成Mg(OH)2沉淀;
(3)①电解时阳极氯离子先放电,电极反应式是:2Cl--2e-=C12↑,次氯酸与铵根反应生成氮气和氢离子,离子方程式是:2NH4++3HClO=N2+3H2O+5H++3Cl-,
故答案为:2Cl--2e-=C12↑;2NH4++3HClO=N2+3H2O+5H++3Cl-;
②pH>10时,溶液中铵根离子变成气态氨挥发,从图1看出Cl-的浓度为8g/L、10g/L、12g/L对氨氮最后的去处率差不多,从节约成本角度考虑选用8g/L;从图2看出,在相同时间内,pH 为8时对有效余氯的影响最大,故选pH 为8,故答案为:8g•L-1;8.
点评 本题考查离子方程式的书写、电解原理等,明确电解反应,电解产物判断是关键,难度不大,注意掌握基础是关键,题目难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
| A. | 澄清石灰水、浓H2SO4 | B. | KMnO4(H+)、浓H2SO4 | ||
| C. | 溴水、NaOH溶液、浓H2SO4 | D. | 浓H2SO4、KMnO4(H+)、NaOH溶液 |
 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题: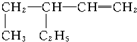 名称:3-乙基-1-戊烯.
名称:3-乙基-1-戊烯. 名称:5-甲基-2-己烯.
名称:5-甲基-2-己烯. 名称:5-甲基-3-庚炔.
名称:5-甲基-3-庚炔.