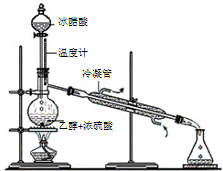
题目内容
12.下列说法正确的是( )| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NO2与水反应氧化剂与还原剂物质的量比为2:1 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 铁露置在空气中一段时间后会生锈;性质更活泼的铝不能稳定存在于空气中 |
分析 A.酸性氧化物能够与碱反应只生成盐和水;
B.依据方程式3NO2+H2O=2HNO3+NO中氮元素化合价变化判断;
C.一氧化氮与氧气反应生成二氧化氮;
D.金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成致密氧化膜.
解答 解:A.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,属于酸性氧化物,故A正确;
B.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量1:2,故B错误;
C.一氧化氮与氧气反应生成二氧化氮,在空气中不能稳定存在,故C错误;
D.金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成致密氧化膜,能阻止了腐蚀,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硅、二氧化氮、一氧化氮、铝的性质是解题关键,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
2.在玻璃中加入溴化银(AgBr)和氧化铜可制得变色镜片,其中所含物质及变色原理如图所示,下列说法不正确的是( )


| A. | 溴化银应避光保存 | |
| B. | 变色镜片可反复变色 | |
| C. | 变色镜片颜色变深的过程发生了化合反应 | |
| D. | 变色镜片中的氧化铜在变色过程中质量不变 |
3.C6H12和C2H6O的混合物中氧的质量分数为8%,则混合物中氢的质量分数为( )
| A. | 8% | B. | 13% | C. | 14% | D. | 78% |
20.下列实验所选装置不合适的是( )

| A. | 分离水和泥沙选① | B. | 从盐水中获得食盐选② | ||
| C. | 分离酒精和水选③ | D. | 由自来水制取纯净水选④ |
17.相同温度,相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④C6H5-ONa ⑤NaHCO3 ⑥Na2CO3,按pH由大到小的顺序排列,正确的是( )
| A. | ⑥>⑤>④>①>③>② | B. | ⑥>④>⑤>①>③>② | C. | ⑥>④>⑤>①>②>③ | D. | ⑥>⑤>④>①>③>② |
4.下列化学用语使用不正确的是( )
| A. | Na+的结构示意图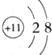 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 纯碱的化学式为Na2CO3 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
2.某研究性学校小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查)
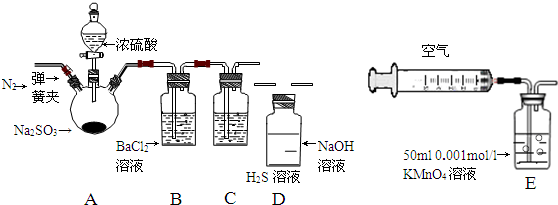
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:
①生成的Na2SO3水解产生OH-(SO32-+H2O?HSO3+OH-);②氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:
①生成的Na2SO3水解产生OH-(SO32-+H2O?HSO3+OH-);②氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |

 ,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.
,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.