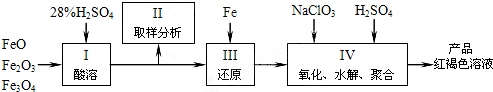
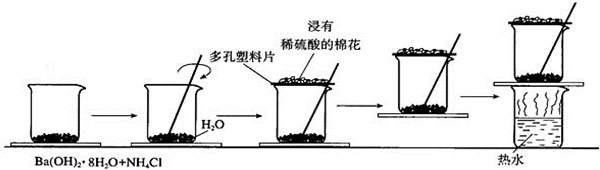
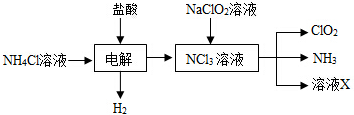
题目内容
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 1 mol的甲基与1 mol的铵根离子所含电子数均为10NA |
分析 A、Na2S和Na2O2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na2S和Na2O2都含1mol阴离子.
B、随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应;
C、铁在氯气中燃烧生成氯化铁,根据方程式计算过量判断,根据不足的物质计算转移电子数;
D、1个甲基含有9个电子,一个氨根离子含有10个电子.
解答 解:A、Na2S和Na2O2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na2S和Na2O2都含1mol阴离子,所以7.8g Na2S和Na2O2的混合物中含有的阴离子为0.1mol,阴离子数等于0.1NA,故A正确;
B、发生反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由方程式可知其氧化剂的硫酸占$\frac{1}{2}$,12.5mL16mol•L-1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16mol•L-1×$\frac{1}{2}$×2×NAmol-1=0.2NA,随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2NA,故B错误;
C、5.6g铁粉的物质的量为0.1mol,铁在氯气中燃烧生成氯化铁,反应方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,所以氯气的物质的量不足,根据氯气计算转移电子数,氯元素化合价由0价降低为-1价,所以转移电子数为0.1mol×2×NAmol-1=0.2NA,故C错误;
D、1mol的甲基所含电子数为9NA,1mol的铵银离子所含电子数为10NA,故D错误;
故选A.
点评 本题考查常用化学计量计算、微粒结构、氧化还原反应、浓度与物质性质关系等,浓度中等,注意C中铁过量与否都生成氯化铁,与铁与硝酸的反应不同.

 阅读快车系列答案
阅读快车系列答案| A. | 60gSiO2晶体中含有2NA个Si-O键 | |
| B. | 18D2O(重水)完全电解,转移2NA个电子 | |
| C. | 1Llmol•L-1 Na2CO3溶液中CO32-数为NA | |
| D. | 16g甲烷含有σ数目为4NA |
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 12.3 |
| A. | 4 | B. | 5 | C. | 9 | D. | 20 |
 如图所示为某有机物的转化关系.完成表格.
如图所示为某有机物的转化关系.完成表格.| 转化序号 | 需加入的反应物及反应条件 |
| ① | |
| ② | |
| ③ | |
| ④ | |
| ⑤ | |
| ⑥ |
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |