题目内容
10.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如图反应制备,下列叙述错误的是( )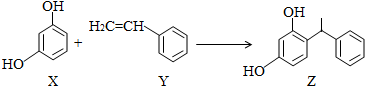
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
分析 A.X和Z中含有酚羟基、Y中含有碳碳双键,苯环上酚羟基邻对位含有氢原子的酚、烯烃都能和溴水反应而使溴水褪色;
B.酚羟基和碳酸氢钠不反应,羧基和碳酸氢钠反应;
C.Y含有碳碳双键和苯环,具有烯烃和苯的性质;
D.Y中含有碳碳双键,能发生加聚反应,X中含有酚羟基,能发生缩聚反应.
解答 解:A.X和Z中含有酚羟基、Y中含有碳碳双键,苯环上酚羟基邻对位含有氢原子的酚、烯烃都能和溴水反应而使溴水褪色,所以X和Z都能和溴水发生取代反应、Y能和溴水发生加成反应,所以三种物质都能使溴水褪色,故A正确;
B.酚羟基和碳酸氢钠不反应,羧基和碳酸氢钠反应,Z和X中都只含酚羟基不含羧基,所以都不能和碳酸氢钠反应,故B错误;
C.Y含有碳碳双键和苯环,具有烯烃和苯的性质,一定条件下能发生加成反应、还原反应、加聚反应、氧化反应、取代反应,故C正确;
D.Y中含有碳碳双键,能发生加聚反应,X中含有酚羟基,能和醛发生缩聚反应,故D正确;
故选B.
点评 本题考查有机物的结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、烯烃的性质,注意只有苯环上酚羟基邻对位有氢原子的酚才能和溴水发生取代反应,为易错点.

练习册系列答案
相关题目
20.常温下,下列说法正确的是( )
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
2.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
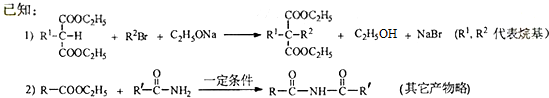
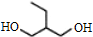
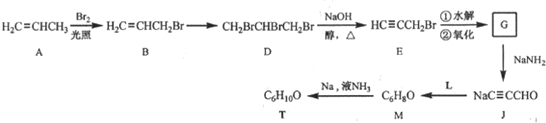
 $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D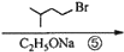
 +2NaBr.
+2NaBr.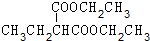 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→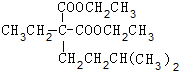 +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr.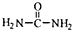 .
.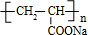 .
.
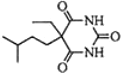
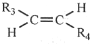 ,则T的结构简式为
,则T的结构简式为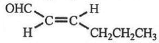 .
.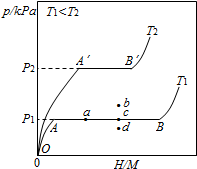 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.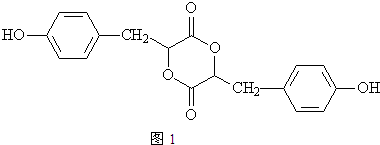

 .
. .
.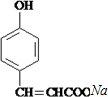 +
+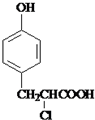 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$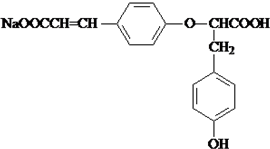 +HCl.
+HCl.