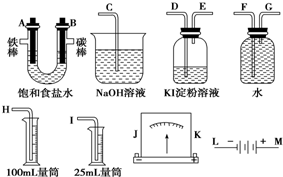
题目内容
14.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的氢离子浓度为0.1mol/L,下列叙述不正确的是( )| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
分析 锌与浓硫酸发生:Zn+2H2SO4═ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4═ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,然后根据反应的化学方程式计算.
解答 解:锌与浓硫酸发生:Zn+2H2SO4═ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4═ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4═ZnSO4+SO2↑+2H2O
xmol xmol
Zn+H2SO4═ZnSO4+H2↑
ymol ymol
A.由反应可知,溶解的Zn为x+y=1.5mol,转移的电子为1.5mol×(2-0)=3mol,故A正确;
B.消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,故B正确;
C.反应中共消耗Zn为1.5mol×65g/mol=97.5 g,故C正确;
D.由反应可知$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=1.8}\end{array}\right.$,解得x=0.3,y=1.2,则气体甲中SO2与H2的体积比为1:4,故D错误;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应及电子、原子守恒为解答的关键,侧重守恒法计算及分析计算能力的综合考查,题目难度不大.

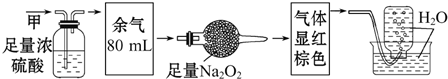
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
| A. | 物质的量浓度均为1 mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) | |
| B. | 等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
| A. | 当△H<0时,表示该反应为吸热反应 | |
| B. | 已知C(s)+O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |

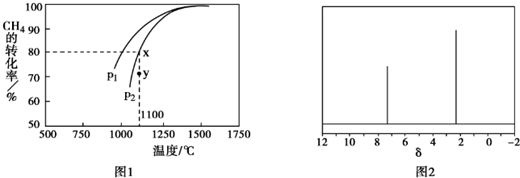
 .
.