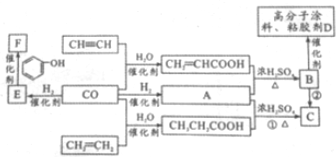
题目内容
1.下列有关化学用语的各种表示正确的是( )| A. | 电子式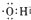 可以表示烃基,也可以表示氢氧根离子 可以表示烃基,也可以表示氢氧根离子 | |
| B. | 磷原子的简化电子排布式:[He]3s23p3 | |
| C. | 聚丙烯链节的结构简式为:-CH2-CH-CH2- | |
| D. | 用惰性电极电解MgCl2溶液的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓ |
分析 A.氢氧根离子带1个单位的负电荷;
B.磷是15号元素,属于主族元素,根据构造原理书写其核外电子排布;
C.聚丙烯的链节主链上有2个碳原子,还有1个甲基支链;
D.电解MgCl2溶液生成氢氧化镁、氯气和氢气.
解答 解:A.氢氧根离子的电子式为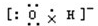 ,羟基的电子式为
,羟基的电子式为 ,故A错误;
,故A错误;
B.磷是15号元素,属于主族元素,由构造原理可知电子排布为:1s22s22p63s23p3,所以磷原子的简化电子排布式:[Ne]3s23p3,故B错误;
C.聚丙烯的链节:-CH2-CH(CH3)-,故C错误;
D.电解MgCl2溶液生成氢氧化镁、氯气和氢气,离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓,故D正确;
故选D.
点评 本题主要考查电子式的书写、核外电子排布式、高聚物的链节、方程式的书写等知识,题目难度中等,注意知识的积累.

练习册系列答案
相关题目
12.二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3为原料合成尿素.经研究发现该反应过程为:
①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
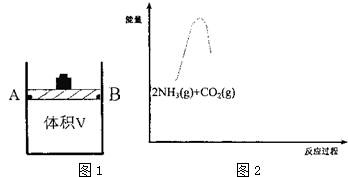
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
①T1℃下,lOmin内NH3的平均反应速率为0.04mol•L-1•min-1.
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.

①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.
9.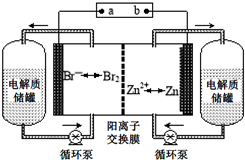 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
6.25℃时,将Na2O2逐渐加入1L含有HCl、AlCl3、MgCl2的混合溶液中,产生沉淀和气体的量与加入Na2O2的量的关系如图所示(假设整个过程中溶液条件变化忽略不计).下列说法错误的是( )
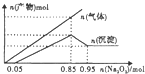

| A. | 混合溶液中m(Al3+)为5.4g | B. | 混合溶液中c(Mg2+)为0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)为1.7mol/L |
13.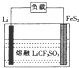 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
10.为实现实验目的,其它主要仪器、试剂及需要在某个部位放置温度计合理的是( )
| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
11.化学与生活密切相关,下列说法不正确的是( )
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |