题目内容
9.下列有关实验的做法或说法正确的是( )| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
分析 A.使温度迅速上升至170°C,防止发生副反应生成乙醚;
B.苯酚溶液中滴入少量稀溴水,生成三溴苯酚溶解在苯酚中,不能观察到白色沉淀;
C.溴乙烷滴入NaOH溶液,加热下发生水解反应,而检验溴离子应在酸性溶液中;
D.铜丝在酒精灯上加热后,生成CuO,CuO可氧化乙醇.
解答 解:A.在制备乙烯的实验中,加热时应使温度迅速上升至170C,不能缓慢加热,故A错误;
B.在苯酚溶液中滴入浓溴水出现白色沉淀,故B错误;
C.将溴乙烷滴入NaOH溶液中,待充分反应,先加酸至酸性,再加入AgNO3溶液后有浅黄色沉淀生成,故C错误;
D.铜丝在酒精灯上加热后,生成CuO,CuO可氧化乙醇,则立即伸入无水乙醇中,铜丝恢复成原来的红色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、有机物制备、离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
19.用98%的浓硫酸(其密度为1.84g/cm3)配制成100mL 1.0mol/L稀硫酸时,实验时遇到下列情况,将会使所配的溶液浓度偏高的是( )
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
17. 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.下列四种X溶液,均能跟相同浓度同体积的盐酸反应,其中反应最快的是( )
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法错误的是( )
| A. | 离子化合物不一定含有金属元素 | B. | 分子晶体中一定含有共价键 | ||
| C. | 原子晶体熔化时破坏共价键 | D. | 离子化合物中可以含有共价键 |
1.下列表示正确的是( )
| A. | CO2的比例模型: | B. | 铝原子的结构示意图: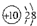 | ||
| C. | 次氯酸的结构式:H-Cl-O | D. | NH3的电子式: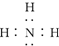 |
18.现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗.有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液.试回答以下问题.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是AC.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
19.下列属于同位素的一组是( )
| A. | 金刚石、石墨 | B. | H、D、T | C. | 1940K、2040Ca | D. | O2、O3 |

 .
. .
.