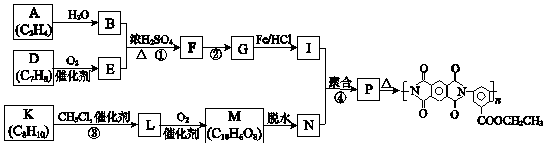
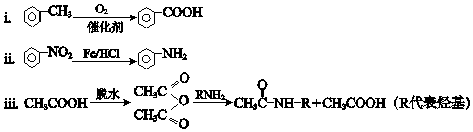题目内容
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:( )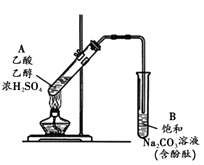
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.取②中上层油状液体测其,共有3组峰
【答案】C
【解析】A.温度越高,浓硫酸的氧化性和脱水性越强,可能使乙醇脱水,降低产率,故A不符合题意;
B. ③中油状液体层变薄主要是乙酸乙酯中的乙醇和盐酸被变化碳酸钠溶液溶解,故B不符合题意;
C. 酚酞是有机物,易溶于有机溶剂,③中红色褪去的原因可能是酚酞溶于乙酸乙酯中,故C符合题意;
D. 乙酸乙酯分子中存在4种不同环境的氢原子,核磁共振氢谱有4组峰,故D不符合题意。
故答案为:C
A.温度过高会使乙醇和乙酸挥发;
B.乙酸乙酯不溶于水;
C.酚酞属于有机物,易溶于有机溶剂;
D.根据乙酸乙酯中等价氢原子的个数进行判断.

 习题精选系列答案
习题精选系列答案【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
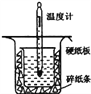
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .