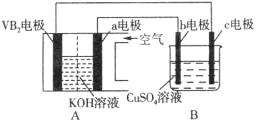
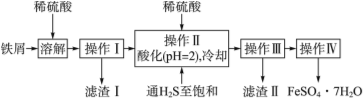
��Ŀ����
����Ŀ�������������ҹ���������������������Ⱥ�����߶ȹ��У�һ����Ϊϸ�������PM2.5��ֱָ��С�ڻ����2.5�Ŀ������ָ������������������ء����ͬʱ���⻯ѧ����Ҳ��ʼ̧ͷ�������ɷǼ�������NOx���ŷ�����ģ�����ʱ��������ֲ�ɫ����������һ������Ⱦ��������Ũ�������ǹ⻯ѧ�����γ��ı�־����ش�����������⣺
��1��������������ϸ������ָ��������� ������ţ���
a��ȼúȡů b�����ͽ�ͨ�豸 c��������ˮ d����ɽ�緢 e���ֲ�ս�� f���ɿ�ҵ
��2����ͼ��ij�ع⻯ѧ�������ձ仯��������ͼ��ʾ��
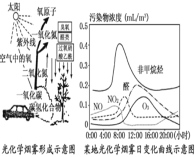
����8:00���Ǽ�������NO���ַ�ֵ�� ���NO2Լ��10:00���ֵ������Ҫ��Ӧ�ķ���ʽ����Ϊ ��8:00��O3��ʼ���ۣ�����13:00���ֵ��O3���������й����й��� O��O2 ��O3���÷�Ӧ�����������ԭ����Ҫ���ɷ�Ӧ�� �����ġ�O3��ʹ10:00ǰNO2�������������ӣ��仯ѧ����ʽΪ ������Ϊ�õع⻯ѧ������������ʱ�������Ϊ ������ţ���
a��8:00 b��10:00 c��15:00 d��20:00
��3����25����101kPa�£������Ħ�����Ϊ24.5L/mol�����������������г���һ����N2O4����NO2 ��N2O4��ƽ�������ܶ�Ϊ3.18 g/Lʱ����������ƽ��Ħ������Ϊ ��N2O4�ķֽ�������ת���ʣ�Ϊ ������������������λ��Ч���֣���
��4��NO��NO2��NH4+��NO2-������Ϊ���Ե����ʣ������ŷŻ��������⡣NH4+��NO2-�ɷ������з�Ӧ��NH4+(aq)��NO2-(aq) ![]() N2(g)��2H2O(l)�ɼӿ�÷�Ӧ�Ĵ�ʩΪ ���÷�Ӧ�ķ�Ӧ���ʷ���Ϊ�� = k��c(NH4+)x��c(NO2-)y������kΪ���ʳ�������һ���¶��£���������ʵ����
N2(g)��2H2O(l)�ɼӿ�÷�Ӧ�Ĵ�ʩΪ ���÷�Ӧ�ķ�Ӧ���ʷ���Ϊ�� = k��c(NH4+)x��c(NO2-)y������kΪ���ʳ�������һ���¶��£���������ʵ����
ʵ����� | c(NH4+)/mol��L-1 | c(NO2-)/mol��L-1 | ��/ mol��L-1��s-1 |
1 | 0.0100 | 0.200 | 5.4��10-7 |
2 | 0.0200 | 0.200 | 1.08��10-6 |
3 | 0.200 | 0.040 | 2.16��10-6 |
4 | 0.200 | 0.060 | 3.24��10-6 |
�ݱ�֪������Һϡ����ԭ�����2������Ӧ�ٶ�����Ϊԭ���� ��
���𰸡���1��abdef ��
��2��2NO+O2=2NO2��NO2=NO+O��O3+NO=NO2+O2 ��c��
��3��77.9g/mol ��18.1����
��4�����¡�����Ӧ��Ũ����1/4��
��������
�����������1������ϸ������ָ���ߣ�Ҳ�����ܲ���С������������ˮ���ܲ���С���������abdef����ȷ�ģ�
��2����10��00�㣬NO2Ũ�ȴﵽ���NO��Ũ����С������NO�����ױ���������������2NO��O2=2NO2������������ԭ�ӣ�Ӧ��NO2�ķֽⷴӦ��NO2=NO��O��NO2�������ӣ�O3Ũ�ȴ�ʱ���٣�˵��O3���뷴Ӧ��O3+NO=NO2+O2 ��������ϢO3Ũ�������ǹܻ�ѧ�����γɵı�־������ͼ���������ص�ʱ��Ӧ��14��00���ң���ѡ��c��ȷ��
��3������M=24.5��=24.5��3.18g/mol=77.9g/mol��N2O4![]() 2NO2���迪ʼʱͶ��2molN2O4���ӦxmolN2O4��������2xmolNO2������ƽ��Ħ�������Ķ��壺77.9=2��92/(2��x��2x)�����x=0.362����ת����Ϊ0.362/2��100%=18.1%��
2NO2���迪ʼʱͶ��2molN2O4���ӦxmolN2O4��������2xmolNO2������ƽ��Ħ�������Ķ��壺77.9=2��92/(2��x��2x)�����x=0.362����ת����Ϊ0.362/2��100%=18.1%��
��4���ӿ췴Ӧ���ʿ��������¶ȡ�����Ũ�ȡ�ʹ�ô����ȣ�ʵ��1��2�����ݴ��빫ʽ������ó���x=1����ʵ��3��4�����ݴ��빫ʽ�������y=1����ʵ��1����Ϊ������������Һ�����Ϊ1L��ϡ��Ϊԭ����2������Ũ�ȷֱ�Ϊ0.01/2mol��L��1��0.2/2mol��L��1�����빫ʽ����Ӧ���ʱ�Ϊԭ����1/4.

 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�