��Ŀ����
����Ŀ��(NH4)2Fe(SO4)2![]() 6H2O��M��392g
6H2O��M��392g![]() mol��1���ֳ�Ī���Σ����FAS����������Դ�ڵ¹���ѧ��Ī����Karl Friedrich Mohr��������dz����ɫ�ᾧ���ĩ���Թ����У��ڿ����л��绯��������������ˮ�������������Ҵ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȡ�
mol��1���ֳ�Ī���Σ����FAS����������Դ�ڵ¹���ѧ��Ī����Karl Friedrich Mohr��������dz����ɫ�ᾧ���ĩ���Թ����У��ڿ����л��绯��������������ˮ�������������Ҵ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȡ�
����Ī���ε���ȡ
�ش��������⣺
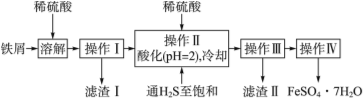
��1������ڱ�����ʣ��������мʱ���й��ˣ���ԭ���� ���������ӷ���ʽ��ʾ��
��2����ȡ��Ī�������Ҫ�� ϴ�ӣ�����ĸ��ţ�����Ŀ���ǣ� ��
a������ˮ b���Ҵ� c����Һ
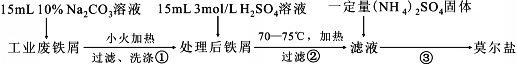
��3������ͼ��ѡȡ�����õ��������ӳ�ʵ������ȡ(NH4)2SO4��Һ��װ�ã����ӵ�˳���ýӿ���ĸ��ʾ����_____________��
����FAS���Ȳⶨ
Ϊ�ⶨFAS���ȣ�ȡm g��Ʒ���Ƴ�500 mL��Һ������������ɣ��ס�����λͬѧ�������������ʵ�鷽����
��1��������ȡ20.00 mLFAS��Һ����0.1000 mol��L��1 ������K2Cr2O7 ��Һ���еζ���
i��д���˷�Ӧ�����ӷ���ʽ�� ��
ii) �ζ�ʱ����ѡ�õ������� ��
��2���ҷ�����ȡ20.00 mLFAS��Һ��������ʵ�顣
![]()
�г�����FAS���崿�ȵĴ���ʽ �����ü�����������
��3����֪ʵ���������ȷ��ȴ���ּ����IJⶨ�������С���ҷ���������ܵ�ԭ���� ����ƼĻ�ѧʵ����֤�����Ʋ� ��
���𰸡���1��Fe + 2Fe3+=3Fe2+
��2��b ����ȥ�������ˮ�֣����پ���ĸ����ֹ����������
��3��a��d��e��f��a��d��e��f��a��d��e��f
��1��i)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
ii)�٢ܢݢ�
��2��392��25W/2��233m��100% ��196��25W/233m��100%
��3��Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+����������������
��������
�����������1��Fe2+���н�ǿ�Ļ�ԭ�Ժ����ױ�����������Ϊ�˷�ֹ��Fe3+���ɣ���Ӧԭ��Ϊ��Fe + 2Fe3+=3Fe2+������ڱ�����ʣ��������мʱ���й�����
�ʴ�Ϊ��Fe + 2Fe3+=3Fe2+��
��2����ȡ��Ī�������Ҫ���Ҵ�ϴ����Ŀ���������Ҵ���ˮ�������ӷ����ص���ȥ�������ˮ�֣����پ���ĸ����ֹ������������
�ʴ�Ϊ��b����ȥ�������ˮ�֣����پ���ĸ����ֹ������������
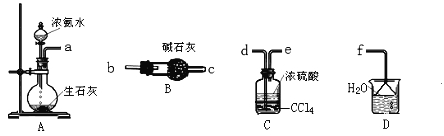
��3����װ��A��ȡ�İ���ͨ��Ũ�����з�����Ӧ����(NH4)2SO4��Һ��Ϊ�˷�ֹ��Ⱦ�����������Dװ�����հ��������ԣ����������ӵ�˳����a��d��e��f��
�ʴ�Ϊ��a��d��e��f��a��d��e��f��a��d��e��f��
��1��i) (NH4)2SO4������K2Cr2O7 ��Һ����������ԭ��Ӧ��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��
�ʴ�Ϊ��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��
ii)��Ϊ(NH4)2SO4������K2Cr2O7 ��Һ�������ü�ʽ�ζ��ܣ������ζ�ʱ����ѡ�õ��������٢ܢݢ���
�ʴ�Ϊ���٢ܢݢ���
��2��Wg����ΪBaSO4�����������غ��֪mg��Ʒ�к�(NH4)2SO4������Ϊ��392��25W/2��233g������Ʒ�Ĵ���Ϊ��392��25W/2��233m��100% =196��25W/233m��100%��
�ʴ�Ϊ��392��25W/2��233m��100% ��196��25W/233m��100%��
��3����֪ʵ���������ȷ��ȴ���ּ����IJⶨ�������С���ҷ���������ܵ�ԭ����Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+������������������
�ʴ�Ϊ��Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+������������������

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�