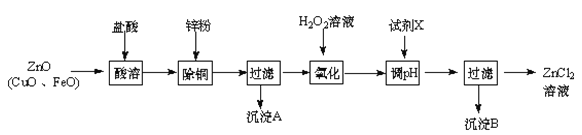
题目内容
【题目】有A、B、C、D、E五种前四周期的元素。A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态。C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8。E位于周期表第12纵列且是六种元素中原子序数最大的。R是由D、E形成的化合物,其晶胞结构如图所示。请回答下列问题:

(1)C元素的电负性___D元素的电负性(填“>”、“<”或“=”)。
(2)C的第一电离能比它同周期前一族相邻元素的第一电离能________
(填“大”或“小”)。
(3)E的价电子排布式为_______ _,该元素位于周期表中__ _族。
(4)化合物A2D的电子式为______________________。
(5)D和B形成的一种化合物D2B2广泛用于橡胶工业,它的分子结构与双氧水相似,但在该化合物分子中,所有原子最外层均满足8电子稳定结构。则D2B2分子中D原子的杂化类型是__________,D2B2是_________分子(填“极性”或“非极性”)。
(6)R的化学式为________________(用元素符号表示)。已知R晶体的密度为ρ g·cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
【答案】
(1)>
(2)小
(3)3d104s2 ; ⅡB
(4) ![]()
(5)sp3 极性
(6)ZnS a = 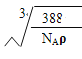
【解析】
试题分析:有A、B、C、D、E五种前四周期的元素,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则B原子的核外2+8+7=17个电子,B为Cl元素,A原子核外有1个未成对电子,A+比B原子少一个电子层,则A为Na元素,C原子的2p轨道有2个未成对电子,C为C或O元素,D的最高化合价和最低化合价的代数和为4,则D为S元素,与C的核电荷数相差8,则C为O元素,E位于周期表第12纵列且是六种元素中原子序数最大的,则E为Zn元素。R是由D、E形成的化合物,根据化合物的晶胞可知,该晶胞中小球个数是4,大球个数=8×1/8+6×1/2=4,所以其化学式为ZnS,R为ZnS。
(1)根据上述推断,C为O元素,D为S元素,元素非金属性越强,其电负性越强,所以电负性C>D;
(2)O的同周期前一族相邻元素为N,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第VA族元素的p轨道处于半充满状态,相对比较稳定,第一电离能大于其相邻元素,O的第一电离能比它同周期前一族相邻元素的第一电离能小;
(3)根据上述分析,E为Zn,Zn是30号元素,位于第四周期,第ⅡB族,所以Zn的价电子排布式为3d104s2 ;
(4) 化合物A2D为Na2S,属于离子化合物,电子式为![]() 。
。
(5) D和B形成的一种化合物D2B2为S2Cl2,它的分子结构与双氧水相似,在该化合物分子中,所有原子最外层均满足8电子稳定结构,所以S2Cl2的结构式为Cl-S-S-Cl,S原子的成键电子对数=2+2=4,所以S的杂化类型是sp3杂化,H2O2是极性分子,则S2Cl2也是极性分子。
(6)根据以上分析知,R的化学式为ZnS,该物质是由阴阳离子构成的,属于离子晶体;该晶胞属于面心立方结构,晶胞的边长=