题目内容
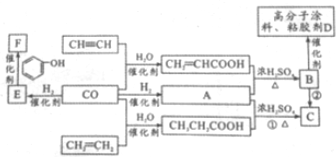
5.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )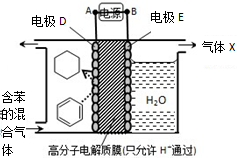
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
分析 根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,据此分析.
解答 解:A、该装置的目的是储氢,所以阴极上发生的反应为生产目标产物,在D电极上苯中的碳得电子生成环己烷,电极反应式为:C6H6+6H++6e-=C6H12,故A正确;
B、E作阳极,在阳极上生成气体X应该具有氧化性,故B错误;
C、电极DE都必须是惰性电极,故C错误;
D、A是负极、B是正极,外电路中电子从B→电极→A,故D错误;
故选A.
点评 本题考查了电解池的反应原理,明确D作阴极,E作阳极,是解答的关键,题目难度中等.

练习册系列答案
相关题目
13.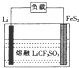 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
20.铝是我们很熟悉的一种金属元素,铊(Tl)和铝均位于元素周期表中的第ⅢA族,铊属于第三周期.则关于铊的下列性质中判断错误的是( )
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
10.为实现实验目的,其它主要仪器、试剂及需要在某个部位放置温度计合理的是( )
| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
14.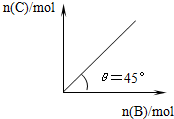 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
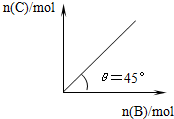 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
15.下列物质不含共价键的是( )
| A. | C2H6 | B. | KOH | C. | MgCl2 | D. | CH3COONa |
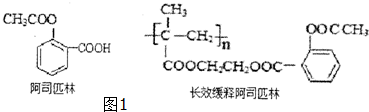
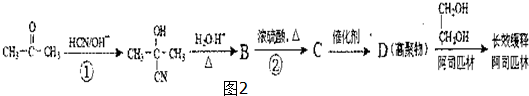
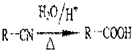 ,回答问题:
,回答问题: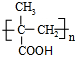 .
.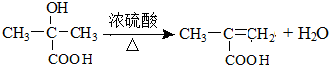 .
.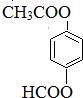 (只写一种).
(只写一种).