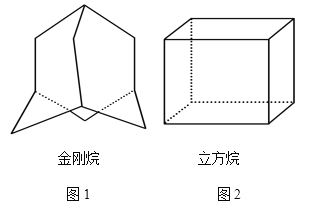
题目内容
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
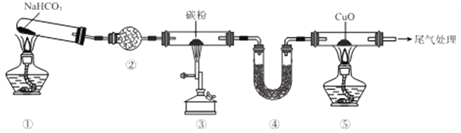
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
【答案】D
【解析】由装置图可知,NaHCO3受热分解生成Na2CO3、H2O和CO2,用装置②除去CO2中混有的H2O(g),CO2与碳粉加热反应生成CO,用装置④除去剩余的CO2,CO与CuO固体加热反应生成CO2和Cu,最后进行尾气处理除去剩余的CO。A. ②中若盛装碱石灰,会把CO2和H2O(g)一并除去,因此②中应盛装P2O5等干燥剂,装置④的作用是除去剩余的CO2,所以装置④中可盛装碱石灰,故A错误;B. 因碳粉会和空气中的氧气、水蒸气等在加热时发生反应,所以应先加热装置①,待整个装置中充满CO2时,再加热③和⑤,故B错误;C. 装置①中发生的是NaHCO3受热分解生成Na2CO3、H2O和CO2的反应,该反应中没有元素化合价发生变化,不是氧化还原反应,③中发生的反应为C+CO2![]() 2CO、⑤中发生的反应为CO+CuO
2CO、⑤中发生的反应为CO+CuO![]() Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。
Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目