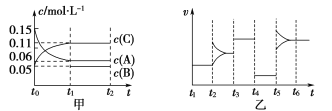
题目内容
【题目】写出下列热化学反应方程式:
(1)1mol硫酸和氢氧化钠稀溶液反应放出115kJ热量,写出表示中和热的热化学反应方程式__。
(2)0.5molC2H5OH(l)完全燃烧生成液态水放出683.4kJ热量,写出表示C2H5OH燃烧热热化学反应方程式___。
(3)24g碳与适量H2O(g)反应吸收262.6kJ热量__。
【答案】![]() H2SO4(aq)+NaOH(aq)═
H2SO4(aq)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l) △H=-57.5kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) H=-1366.8kJ/mol C(s)+H2O(g)=H2(g)+CO(g) H=+131.3kJ/mol
Na2SO4(aq)+H2O(l) △H=-57.5kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) H=-1366.8kJ/mol C(s)+H2O(g)=H2(g)+CO(g) H=+131.3kJ/mol
【解析】
(1)1mol硫酸和氢氧化钠稀溶液反应生成2mol H2O,放出115kJ热量,而中和热是指在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则中和热的热化学方程式为:![]() H2SO4(aq)+NaOH(aq)═
H2SO4(aq)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l) △H=-57.5kJ/mol;
Na2SO4(aq)+H2O(l) △H=-57.5kJ/mol;
(2)0.5molC2H5OH(l)完全燃烧生成液态水放出683.4kJ热量,表示C2H5OH燃烧热,应为1molC2H5OH(l)完全燃烧放出的热量为683.4kJ×![]() =1366.8kJ,反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) H=-1366.8kJ/mol;
=1366.8kJ,反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) H=-1366.8kJ/mol;
(3)24g C 的物质的量为n(C)=![]() =
=![]() =2mol,2mol碳反应吸收262.6kJ热量,1molC 反应吸收131.3kJ热量,则C 与足量H2O(g)反应生成CO(g)和H2(g)的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ/mol。
=2mol,2mol碳反应吸收262.6kJ热量,1molC 反应吸收131.3kJ热量,则C 与足量H2O(g)反应生成CO(g)和H2(g)的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ/mol。

 名校课堂系列答案
名校课堂系列答案