题目内容
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/10。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:_____________________;负极:____________________。
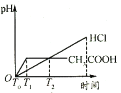
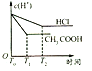
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用_______________。
A.铜 B.钠 C.锌 D.石墨
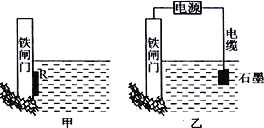
(3)上图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的_____________极。
(4)除了以上金属防护的方法外,请再例举两种办法:___________;___________。
【答案】O2+4e-+2H2O=4OH- 2Fe-4e- = 2Fe2+ C 负 改变金属组成或内部结构 在金属的表面覆盖保护层(其它合理答案也可以)
【解析】
如图甲所示,铁闸门-金属R-海水构成原电池,铁做正极得到保护,所以属于原电池原理。如图乙所示,铁闸门与电源负极相连,作阴极,得到保护,该装置称为外加电流的阴极保护法。
(1)钢铁发生吸氧腐蚀,负极上Fe失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。
(2)作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,根据图知,该装置是利用原电池原理保护Fe,所以应该选取比Fe活泼的金属,如锌。不能选择钠,钠太活泼,直接和水发生反应。
(3)作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,根据图知,该装置是利用电解池原理保护Fe,则铁作电解池阴极,应该连接电源负极,故答案为:负。
(4)金属防护的方法还有在金属的表面覆盖保护层、改变金属内部结构等方法。

【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
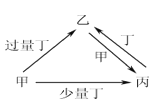
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D