题目内容
【题目】某温度下,向2L恒容密闭容器中充入1molA和1molB,发生反应A(g)+B(g) ![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率V(A)=0.03mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol·L-1,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2molA.0.2molB和1.0molC,反应达到平衡前反应速率V(正)<V(逆)
【答案】D
【解析】
依据化学平衡三段式列式计算;
A(g)+B(g)![]() C(g)
C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
A、依据V(A)=![]() 计算;
计算;
B、平衡状态A的物质的量为0.8mol,升高温度,平衡时c(A)=0.41molL-1,物质的量为0.82mol,物质的量增大,说明平衡逆向进行;
C、等效为起始加入2.0molA和2.0molB,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的A、B转化率较原平衡高,故平衡时A、B的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断;
D、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向。
A的物质的量达到0.80mol反应达到平衡状态,则
A(g)+B(g)![]() C(g)
C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
K=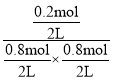 =0.625
=0.625
A、反应在前5s的平均速率v(A)=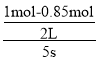 =0.015 mol/(L·s),故A错误;
=0.015 mol/(L·s),故A错误;
B、保持其他条件不变,升高温度,平衡时c(A)=0.41molL1,A物质的量为0.41mol/L×2L=0.82mol>0.80mol,说明升温平衡逆向进行,正反应是放热反应,则反应的△H<0,故B错误;
C、等效为起始加入2.0molA和2.0molB,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的A、B转化率较原平衡高,故平衡时A、B的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,转化率小于80%,故C错误;
D、相同温度下,起始时向容器中充入0.20molA、0.20molB和1.0molC,Qc=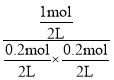 =50>K,反应逆向进行,反应达到平衡前v(正)<v(逆),故D正确。
=50>K,反应逆向进行,反应达到平衡前v(正)<v(逆),故D正确。

 应用题作业本系列答案
应用题作业本系列答案【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________、_________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)
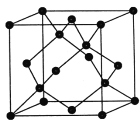
①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化简,阿伏加德罗常数为NA)

