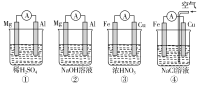
题目内容
【题目】对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O ![]() H3O + S2- ,加水稀释,平衡向逆反应方向移动
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g) ![]() 2HI(g) :扩大容器体积,平衡不移动
2HI(g) :扩大容器体积,平衡不移动
【答案】C
【解析】
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,生成物浓度减小,反应正向移动,故A正确;
CaO(s) +CO2(g),减小CO2浓度,生成物浓度减小,反应正向移动,故A正确;
B.反应4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g)是气体体积增大的反应,增大压强,平衡向逆反应方向移动,故B正确;
4NO(g) +6H2O(g)是气体体积增大的反应,增大压强,平衡向逆反应方向移动,故B正确;
C.反应HS- + H2O ![]() H3O + S2-是水解反应,加水稀释,平衡向正反应方向移动,故C错误;
H3O + S2-是水解反应,加水稀释,平衡向正反应方向移动,故C错误;
D.反应H2(g) + I2(g) ![]() 2HI(g)是气体体积不变的反应,扩大容器体积,平衡不移动,故D正确;
2HI(g)是气体体积不变的反应,扩大容器体积,平衡不移动,故D正确;
故选C。

【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子 质量 | 溶解性 |
苯甲醛 | 178.1 | 1.045 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.045 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.1mL(约3.24g)苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到1.908g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号)。


(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
【题目】某温度下,向2L恒容密闭容器中充入1molA和1molB,发生反应A(g)+B(g) ![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率V(A)=0.03mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol·L-1,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2molA.0.2molB和1.0molC,反应达到平衡前反应速率V(正)<V(逆)
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
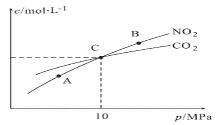
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。