题目内容
【题目】现有如下物质:
①明矾 ②一水合氨 ③碳酸氢钠 ④硫酸铁 ⑤硝酸钡 ⑥硝酸
请完成下列问题:
(1)属于弱电解质的是___________________;(选填编号)
(2)由于促进水的电离平衡而使溶液显酸性的是__________________;(选填编号)
(3)它们水溶液PH >7的有_________________;(选填编号)
(4)写出下列物质之间发生反应的离子方程式:
①+⑤__________________ ②+④___________________ ③+⑥__________________
(5)明矾溶于水后能净水,是由于Al3+水解后能形成Al(OH)3胶体,该胶体具有吸附性,请写出Al3+水解的方程式:____________________;
硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式中x、y、z的值分别为_______________(填整数)
【答案】② ①④ ②③ SO42-+Ba2+=BaSO4![]() Fe3++3NH3·H2O=Fe(OH)3
Fe3++3NH3·H2O=Fe(OH)3![]() +3NH4+ HCO3-+H+=CO2
+3NH4+ HCO3-+H+=CO2![]() +H2O Al3++3H2O
+H2O Al3++3H2O![]() Al(OH)3+3H+ 2、 5、 17
Al(OH)3+3H+ 2、 5、 17
【解析】
(1)明矾是可溶性盐,属于强电解质;一水合氨是一元弱碱,属于弱电解质;碳酸氢钠、硫酸铁和硝酸钡是可溶性盐,属于强电解质;硝酸是强酸,属于强电解质;
(2)明矾是可溶性盐,在水中电离出Al3+,氯离子水解使溶液呈酸性;硫酸铁在溶液中电离出铁离子,铁离子水解使溶液呈酸性;;
(3)一水合氨是一元弱碱,水溶液PH >7;碳酸氢钠属于弱酸强碱盐,其水溶液呈碱性,pH >7;
(4)明矾和硝酸钡反应生成硫酸钡沉淀、硝酸钾和硝酸铝;一水合氨和硫酸铁反应生成氢氧化铁和硫酸铵;碳酸氢钠和硝酸反应生成二氧化碳和硝酸钠;
(5) Al3+水解生成氢氧化铝;
(6) 取5.130g碱式硫酸铁(xFe2O3ySO3zH2O),溶于足量盐酸中,则所得的溶液中含Fe3+和SO42-。加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g即BaSO4,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体氧化铁,根据硫原子和铁原子守恒规律解答。
(1)明矾是可溶性盐,属于强电解质;一水合氨是一元弱碱,属于弱电解质;碳酸氢钠、硫酸铁和硝酸钡是可溶性盐,属于强电解质;硝酸是强酸,属于强电解质,属于弱电解质的是②;
(2)明矾是可溶性盐,在水中电离出Al3+,铝离子水解使溶液呈酸性;硫酸铁在溶液中电离出铁离子,铁离子水解使溶液呈酸性;由于促进水的电离平衡而使溶液显酸性的是①④;
(3)一水合氨是一元弱碱,水溶液PH >7;碳酸氢钠属于弱酸强碱盐,其水溶液呈碱性,pH >7;水溶液PH >7的有②③;
(4)明矾和硝酸钡反应生成硫酸钡沉淀、硝酸钾和硝酸铝,离子方程式为:SO42-+Ba2+=BaSO4![]() ;一水合氨和硫酸铁反应生成氢氧化铁和硫酸铵,离子方程式为:Fe3++3NH3·H2O=Fe(OH)3
;一水合氨和硫酸铁反应生成氢氧化铁和硫酸铵,离子方程式为:Fe3++3NH3·H2O=Fe(OH)3![]() +3NH4+;碳酸氢钠和硝酸反应生成二氧化碳和硝酸钠,离子方程式为:HCO3-+H+=CO2
+3NH4+;碳酸氢钠和硝酸反应生成二氧化碳和硝酸钠,离子方程式为:HCO3-+H+=CO2![]() +H2O;
+H2O;
(5) Al3+水解生成氢氧化铝,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(6) 取5.130g碱式硫酸铁(xFe2O3ySO3zH2O),溶于足量盐酸中,则所得的溶液中含Fe3+和SO42-。加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g即BaSO4,其物质的量n=![]() =0.025mol,根据S原子的守恒即可知碱式硫酸铁(xFe2O3ySO3zH2O)中“SO3”的物质的量为0.025mol,质量m=nM=0.025mol×80g/mol=2.00g;上述滤液中还含有Fe3+,加入过量的NaOH溶液,即得Fe(OH)3沉淀,经过滤、洗涤、灼烧得到固体1.600g即为Fe2O3,由于转化过程中铁元素的守恒,故碱式硫酸铁(xFe2O3ySO3zH2O)中“Fe2O3”的质量即为1.600g,其物质的量n=
=0.025mol,根据S原子的守恒即可知碱式硫酸铁(xFe2O3ySO3zH2O)中“SO3”的物质的量为0.025mol,质量m=nM=0.025mol×80g/mol=2.00g;上述滤液中还含有Fe3+,加入过量的NaOH溶液,即得Fe(OH)3沉淀,经过滤、洗涤、灼烧得到固体1.600g即为Fe2O3,由于转化过程中铁元素的守恒,故碱式硫酸铁(xFe2O3ySO3zH2O)中“Fe2O3”的质量即为1.600g,其物质的量n=![]() =0.01mol,而碱式硫酸铁(xFe2O3ySO3zH2O)的质量共为5.130g,则可知其含有的“H2O”的质量m=5.13g-2.00g-1.600g=1.53g,物质的量n=
=0.01mol,而碱式硫酸铁(xFe2O3ySO3zH2O)的质量共为5.130g,则可知其含有的“H2O”的质量m=5.13g-2.00g-1.600g=1.53g,物质的量n=![]() =0.085mol。故该样品中x:y:Z=0.01mol:0.025mol:0.085mol=2:5:17。
=0.085mol。故该样品中x:y:Z=0.01mol:0.025mol:0.085mol=2:5:17。

【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
【题目】某温度下,向2L恒容密闭容器中充入1molA和1molB,发生反应A(g)+B(g) ![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率V(A)=0.03mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol·L-1,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2molA.0.2molB和1.0molC,反应达到平衡前反应速率V(正)<V(逆)
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
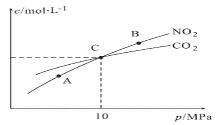
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。