题目内容
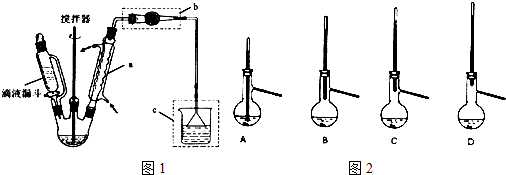
16. 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:①如图装置中,为了酸碱能更充分地反应,应该增加一个环形搅拌器(或环形玻璃棒)(填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会偏小(填“偏大”、“偏小”或“无影响”).
②在操作正确的前提下提高中和热测定的准确性的关键是B( 填代号)
A.进行实验时的气温
B.装置的保温隔热效果
C.实验所用酸碱溶液的体积
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将偏大(填“偏大”、“偏小”、“不变”);原因是固体NaOH溶于水放热.
分析 ①中和热的测定时,应用环形玻璃搅拌棒来搅拌;如果没有盖硬纸板,会导致热量的损失,据此分析对中和热的影响;
②根据在中和反应中,必须确保热量不散失来分析;
③氢氧化钠固体溶于水放出热量.
解答 解:①中和热的测定时,为了加快反应速率、使反应充分进行,应用环形玻璃搅拌棒来搅拌;如果没有盖硬纸板,会导致热量的损失,则导致所测得的中和热的数值偏小,故答案为:环形搅拌器(或环形玻璃棒);偏小;
②在中和反应中,必须确保热量不散失,故操作过程中的保温隔热是关键,故选B;
③氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大,故答案为:偏大;氢氧化钠固体溶于水放热.
点评 本题考查化学实验基本操作和中和热测定的实验,保温工作是实验成功的关键,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
4.美国 lawrece liremore 国家实验室(LINL)的V•Lota•C•S•You和H•Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同分异构体 | |
| B. | 在一定的条件下,转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和分子晶体具有相同的物理性质和化学性质 | |
| D. | 在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合 |
11.S-诱抗素的分子结构如右图所示,它可以保证鲜花盛开.下列关于该物质的说法正确的是( )


| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
1.下列化合物中,只存在共价键的是( )
| A. | NaOH | B. | H2O | C. | KCl | D. | CaO |
5.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质.下列结论正确的是( )
| A. | 加入有色布条,片刻后有色布条褪色,说明有Cl2存在 | |
| B. | 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在 | |
| C. | 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在 |
6.在温度t℃下,某Ba(OH)2的稀溶液中?c(H+)=10-amol.L-1,c(OH-)=10-b mol.L-1,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃大于25℃(填”大于”“小于”或”等于”),该温度下水的离子积KW=1×10-12.
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
 K+,⑤的结构式是O=C=O.
K+,⑤的结构式是O=C=O. 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应: