题目内容
8. 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+H2SO4═ZnSO4+H2↑
(1)负极材料Zn;正极材料C;电解质溶液H2SO4.
(2)写出电极反应式:正极:2H++2e-=H2↑;负极:Zn-2e-=Zn2+.
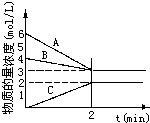
(3)已知某一化学反应情况如图,请回答
①2分钟内A的平均速率是1.5mol/(L•min);②该反应方程式为3A+B?2C.
分析 (1)电极中负极比正极活泼,是失电子的极,电解质中的阳离子在正极得电子;
(2)正极上氢离子得电子生成氢气,负极Zn失电子生成锌离子;
(3)①据v=$\frac{△c}{△t}$计算;
②据ABC的变化趋势判断反应物和生成物,据变化量确定化学计量数,最后达到平衡状态,所以为可逆反应.
解答 解:(1)据反应方程式分析,Zn失电子作负极,Cu或C作正极,电解质溶液为硫酸,故答案为:Zn;C;H2SO4;
(2)正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,负极Zn失电子生成锌离子,电极反应式为Zn-2e-=Zn2+,
故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;
(3)①据v=$\frac{△c}{△t}$=$\frac{(6-3)mol/L}{2min}$=1.5mol/(L•min),故答案为:1.5mol/(L•min);
②据ABC的变化趋势判断反应物为AB,生成物为C,ABC的变化量分别为3、1、2,确定ABC的化学计量数分别为3、1、2,最后达到平衡状态,所以为可逆反应,反应方程式为3A+B?2C,故答案为:3A+B?2C.
点评 本题考查了原电池的设计、电极反应式书写、化学反应速率的计算以及据浓度变化图书写化学方程式,难点是据浓度变化图书写化学方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18. 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )| A. | a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2 | |
| B. | a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2 | |
| C. | a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3 | |
| D. | a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3 |
19.下列说法中一定不正确的是( )
| A. | 某原子K层上只有一个电子 | |
| B. | 某离子L层和M层上的电子数均为K层的4倍 | |
| C. | 某离子M层上的电子数为L层上的4倍 | |
| D. | 某离子的核电荷数与最外层电子数相等 |
3.下列关于有机化合物中同分异构的说法,正确的是( )
| A. | 分子组成相同的化合物 | B. | 分子构造相同的化合物 | ||
| C. | 分子组成相同而构造不同的化合物 | D. | 分子组成与构造都不相同的化合物 |
13.下列有机物的命名正确的是( )
| A. | 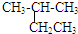 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CHBrCH3 2-溴丁烷 | ||
| C. |  间二甲苯 间二甲苯 | D. | 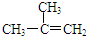 2-甲基-2-丙烯 2-甲基-2-丙烯 |
20.下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
| A. |  石油蒸馏 | B. |  实验室用乙醇制取乙烯 | ||
| C. |  实验室制取乙酸乙酯 | D. |  证明酸性:盐酸>碳酸>苯酚 |
18.下列说法正确的是( )
| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: