题目内容
6.在温度t℃下,某Ba(OH)2的稀溶液中?c(H+)=10-amol.L-1,c(OH-)=10-b mol.L-1,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
分析 (1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=1×10-12,常温下Kw=10-14,结合水的电离是吸热过程分析;
(2)由③可知,等体积混合溶液为中性,则HCl与碱电离的氢氧根离子浓度相同,结合①计算c(0H-);
(3)沉淀正好达最大量,硫酸根离子完全反应,从4L溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,即NaOH溶液的pH=7,c(OH-)=$\frac{Kw}{1{0}^{-7}}$mol/L,结合守恒计算.
解答 解:(1)在Ba(OH)2稀溶液中水的离子积常数Kw=c(H+)•c(OH-)=10-a×10-b=10-(a+b)=1×10-12,常温下Kw=10-14,说明溶液的温度大于25℃,且有该温度下pH+pOH=12,中性溶液的pH等于6,故答案为:大于;1×10-12;
(2)由①可知Ba(OH)2溶液中c(0H-)=10-4mol/L,c[Ba(OH)2]=5×10-5mol/L,当滴入盐酸22 mL时溶液呈中性时有c(H+)=c(0H-),所以原盐酸的浓度为10-4mol/L,pH=b=4,故答案为:4;5×10-5mol/L;
(3)设混合溶液中H2SO4的物质的量为x,Na2SO4的物质的量为y,沉淀正好达最大量,硫酸根离子完全反应,所加入的Ba(OH)2与硫酸根离子恰好完全反应时有:
x+y=3L×5×10-5mol/L,
由从4L溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,可知10-4mol/L×3L-2x=10-5mol/L×20×10-3L×1000,
联立两式解得x=5×10-5mol/L,y=1×10-4mol/L,则硫酸中c(H+)=×10-4mol/L,pH=4,
故答案为:4;1×10-4.
点评 本题考查酸碱混合的计算,为高频考点,把握该温度下Kw及酸碱混合后溶质的变化、pH的简单计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 实验室制备氯气 MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 用氨水吸收少量二氧化硫2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Cl2通入水中Cl2+H2O?H++Cl-+HClO |
| A. | SO2→H2SO4 | B. | Al(OH)3→Al2O3 | C. | SiO2→H2SiO3 | D. | Fe(OH)2→Fe(OH)3 |
| A. | XY2 | B. | Y2X3 | C. | Y4X | D. | YX3 |
| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: .
. $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$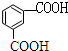
 ;
;