题目内容
7.现有①Ar ②金刚石 ③NH4Cl ④SiO2 ⑤干冰 ⑥K2S六种物质,按下列要求回答:(填序号)(1)只存在共价键的是②④,既存在离子键又存在共价键的是③.
(2)熔化时不需要破坏化学键的是①⑤.
(3)⑥的电子式是K+
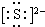 K+,⑤的结构式是O=C=O.
K+,⑤的结构式是O=C=O.
分析 (1)共价键为非金属原子之间形成的化学键,离子键为阴阳离子之间形成的化学键,根据物质的组成进行判断;
(2)根据物质含有的化学键类型以及变化类型进行判断;
(3)根据物质的晶体类型以及电子式的书写方法书写电子式.
解答 解:①Ar为单原子分子,不存在化学键,熔化时不需要破坏化学键;
②金刚石为原子晶体,存在共价键,熔化时需要破坏共价键;
③NH4Cl为离子化合物,既存在离子键又存在共价键,熔化时需要破坏离子键;
④SiO2为原子晶体,存在共价键,熔化时需要破坏共价键;
⑤干冰为分子晶体,含有共价键,熔化时不需要破坏化学键,破坏的是分子间作用力;
⑥K2S为离子化合物,只含有离子键,电子式为K+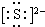 K+,熔化时需要破坏离子键,
K+,熔化时需要破坏离子键,
(1)只存在共价键的是②④,既存在离子键又存在共价键的是③,故答案为:②④;③;
(2)熔化时不需要破坏化学键的是①⑤,故答案为:①⑤;
(3)⑥的电子式是K+ 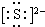 K+,⑤的结构式是O=C=O,故答案为:K+
K+,⑤的结构式是O=C=O,故答案为:K+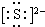 K+; O=C=O.
K+; O=C=O.
点评 本题考查化学键的类型以及变化时的化学键的变化,注意物理变化与化学变化的区别,以及化学键与分子间作用力的区别,注意共价化合物和离子化合物的电子式的书写.

练习册系列答案
相关题目
18.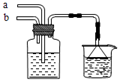 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )| A. | a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2 | |
| B. | a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2 | |
| C. | a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3 | |
| D. | a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3 |
15.下列变化属于物理变化的是( )
| A. | 氧气在放电条件下变成臭氧 | B. | 加热胆矾成白色无水硫酸铜 | ||
| C. | 漂白的草帽久置空气中变黄 | D. | 氢氧化铁胶体加入硫酸镁产生沉淀 |
12.已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)→3Fe(NO3)3+NO↑+2H2O,现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
(1)放出4480mL气体时,消耗金属的质量为16.8g
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
19.下列说法中一定不正确的是( )
| A. | 某原子K层上只有一个电子 | |
| B. | 某离子L层和M层上的电子数均为K层的4倍 | |
| C. | 某离子M层上的电子数为L层上的4倍 | |
| D. | 某离子的核电荷数与最外层电子数相等 |
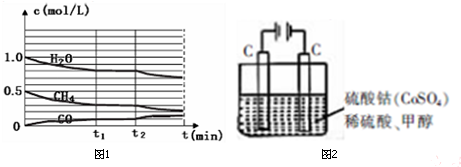
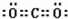 ;
;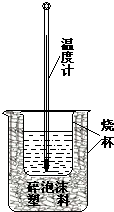 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: