题目内容
11.下列关于配合物说法正确的是( )| A. | 配离子只能存在于晶体中 | |
| B. | 配位体只能是多原子分子 | |
| C. | 配合物的稳定性是指配合物在受热情况下是否易分解 | |
| D. | 血红素中的Fe2+与CO形成的配合物比与O2形成的配合物稳定 |
分析 A.配离子也能存在于溶液中;
B.能作为配合物配位体的微粒需含有孤对电子可以是多原子分子,也可为离子;
C.配合物的稳定性指中心离子和配体的结合能力,配合物中配位键越强,配合物越稳定;
D.配合物中配位键越强,配合物越稳定,中心离子相同,稳定性与配体有关;
解答 解:A.提供空轨道的离子和提供孤电子对的分子或离子能形成配位键,配离子可存在于晶体中,也可存在于溶液中,如:SCN-的电子式 ,铁离子提供空轨道,硫原子提供孤电子对,溶液中络合物Fe(SCN)3含有配位键,故A错误;
,铁离子提供空轨道,硫原子提供孤电子对,溶液中络合物Fe(SCN)3含有配位键,故A错误;
B.能作为配合物配位体的微粒需含有孤对电子,可以是多原子、分子如:NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为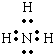 ,有孤对电子,可以作为配体,也可为离子如:Cl-为氯原子得到1个电子形成的阴离子,电子式为
,有孤对电子,可以作为配体,也可为离子如:Cl-为氯原子得到1个电子形成的阴离子,电子式为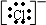 ,有孤对电子,可以作为配体,故B错误;
,有孤对电子,可以作为配体,故B错误;
C.配合物的稳定性与配位键强弱有关,键强弱中心离子受电荷、离子半径等影响,配体受酸碱性等影响,所以配合物配位键越强,配合物越稳定,与受热情况下是否易分解无关,故C错误;
D.血红素中的Fe2+分别与CO、O2形成的配合物,中心离子Fe2+相同,配体CO形成的配位键强,所以Fe2+与CO形成的配合物比与O2形成的配合物稳定,所以人体CO易中毒,故D正确;故选D.
点评 本题考查了配合物的有关知识,掌握配合物的构成以及中心离子和配体间的关系是解答的关键,题目难度中等.

练习册系列答案
相关题目
1.把下列四种X溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
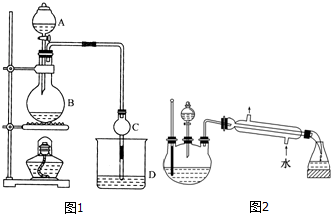
19.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含180)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH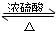 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH
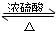 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.
6.某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.
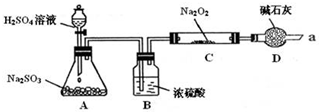
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.

写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
3.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):(注意:氢气体积均在标准状况下测定的 )
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3min,原因是该反应是放热反应,此时温度高.
②哪一段时段的反应速率最小4~5min,原因是H+浓度小.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
②哪一段时段的反应速率最小4~5min,原因是H+浓度小.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是AB.
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在2L的密闭容器中进行,1min后,NH3减少0.12mol,则该反应的化学反应速率是( )
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
1.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |