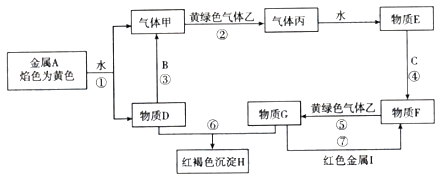
题目内容
【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 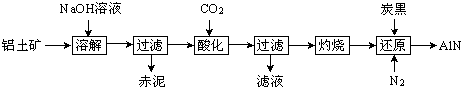
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
【答案】
(1)Fe2O3、Na2Al2Si2O8
(2)NaHCO3;漏斗
(3)Al2O3+N2+3C ![]() 2AlN+3CO
2AlN+3CO
(4)解:根据反应AlN+NaOH+H2O═NaAlO2+NH3↑利用实验Ⅰ数据可知,
n(AlN)=n(NH3)= ![]() mol=0.065 mol,所以AlN的质量分数为:
mol=0.065 mol,所以AlN的质量分数为: ![]() ×100%=65%,
×100%=65%,
答:AlN的质量分数为65%
②所用NaOH溶液的浓度为 mol/L.
9.5
【解析】解:铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8 , 滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,(1)根据上面的分析可知,赤泥的主要成分为 Fe2O3、Na2Al2Si2O8 , 故答案为:Fe2O3、Na2Al2Si2O8; (2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为 NaHCO3 , 实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:NaHCO3;漏斗;(3)氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,反应的化学方程式为Al2O3+N2+3C ![]() 2AlN+3CO,
2AlN+3CO,
故答案为:Al2O3+N2+3C ![]() 2AlN+3CO;(4)比较表中三组数据可知,实验Ⅱ中固体的质量为实验Ⅰ中的两倍时,产生的气体的体积也为两倍,说明在实验Ⅰ中氢氧化钠是过量的,实验Ⅲ的固体为实验Ⅰ的3倍,而气体没有达到3倍,说明在实验Ⅲ中固体过量,氢氧化钠全部参加 反应,
2AlN+3CO;(4)比较表中三组数据可知,实验Ⅱ中固体的质量为实验Ⅰ中的两倍时,产生的气体的体积也为两倍,说明在实验Ⅰ中氢氧化钠是过量的,实验Ⅲ的固体为实验Ⅰ的3倍,而气体没有达到3倍,说明在实验Ⅲ中固体过量,氢氧化钠全部参加 反应,
②根据反应AlN+NaOH+H2O═NaAlO2+NH3↑利用实验Ⅲ数据可知,n(NaOH)=n(NH3)= ![]() mol=0.19 mol,所以NaOH溶液的浓度为:
mol=0.19 mol,所以NaOH溶液的浓度为: ![]() =9.5mol/L,
=9.5mol/L,
故答案为:9.5.
铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8 , 滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,据此答题;