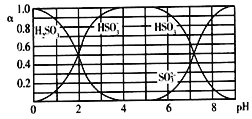
题目内容
【题目】锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性。下列关于锂的判断可能正确的是
A.Li能在空气中燃烧B.Li2O熔点较低
C.Li2CO3能溶于水D.LiOH受热时不易分解
【答案】A
【解析】
有“对角线”关系的元素性质存在相似性,所以镁和锂的性质应该相似。
A、镁可以在空气中燃烧,所以Li也能在空气中燃烧,A正确;
B、氧化镁的熔点很高,所以Li2O的熔点也应该较高,B错误;
C、碳酸镁难溶于水,所以Li2CO3难溶于水,C错误;
D、氢氧化镁受热易分解,所以LiOH受热时易分解,D错误;
答案是A。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 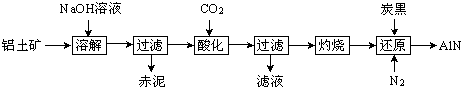
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
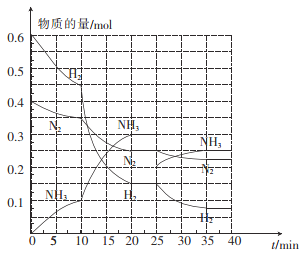
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)