题目内容
19.电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题.方法一:称取1.04g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448mL(不考虑乙炔在水中的溶解,下同).
(1)电石水解生成乙炔气体的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称.

(3)对获得准确的气体体积无益的操作有③(填序号).
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平.
(4)由以上数据可计算出样品中CaC2的质量分数为91.43%.
方法二:称取1.04g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+5O2═2CaO+4CO2
.

(5)反应时石英管管壁易被腐蚀,试用化学方程式解释其原因CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3.
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为除去CO2中混有的SO2等.
(7)通入空气的作用是:提供氧气,将产生的二氧化碳气体全部赶入丙中充分吸收.
(8)由此方法测得的样品中CaC2的质量分数比方法一中的大(填“大”、“小”或“相等”),从实验装置的角度看,原因为a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大.
分析 (1)电石与水反应生成氢氧化钙和乙炔;
(2)由于生成的乙炔气体中含有杂质,因此需要利用硫酸铜溶液或氢氧化钠溶液除去,乙炔的密度和空气很接近,一般用排水法收集;
(3)①检查装置的气密性,可以防止生成的乙炔损失,因此对获得准确的气体体积有益;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平可以使内外压强相等,对获得准确的气体体积有益;
③由于反应前装置中就存在空气,所以在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中对获得准确的气体体积无益;
④读数时视线与量筒内凹液面最低点相平对获得准确的气体体积有益;
(4)乙炔的物质的量是0.448L÷22.4L/mol=0.02mol,则根据方程式可知碳化钙的物质的量也是0.02mol,其质量=0.02mol×64g/mol=1.28g,所以计算得到碳化钙的质量分数;
(5)由于碳化钙生成的氧化钙是碱性氧化物,能和玻璃中的二氧化硅反应生成硅酸钙,从而腐蚀管壁;
(6)由于电石中含有杂质元素S等,在反应中生成SO2,也能被氢氧化钠溶液吸收干扰CO2的测量,所以需要酸性高锰酸钾溶液除去CO2中混有的SO2等杂质气体;
(7)通入空气的作用是提供氧气,把生成的二氧化碳气体全部赶入装置丙中吸收,减少测定误差;
(8)由于空气中也含有CO2,因此a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大.
解答 解:(1)电石与水反应生成氢氧化钙和乙炔,因此电石水解生成乙炔气体的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)由于生成的乙炔气体中含有杂质,因此需要利用硫酸铜溶液或氢氧化钠溶液除去,乙炔的密度和空气很接近,一般用排水法收集,所以正确的连接和试剂为: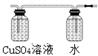 ,故答案为:
,故答案为: ;
;
(3)①检查装置的气密性,可以防止生成的乙炔损失,因此对获得准确的气体体积有益;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平可以使内外压强相等,对获得准确的气体体积有益;
③由于反应前装置中就存在空气,所以在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中对获得准确的气体体积无益;
④读数时视线与量筒内凹液面最低点相平对获得准确的气体体积有益;
故答案为:③;
(4)乙炔的物质的量是$\frac{0.448L}{22.4L/mol}$=0.02mol,则根据方程式可知碳化钙的物质的量也是0.02mol,其质量=0.02mol×64g/mol=1.28g,所以碳化钙的质量分数=$\frac{1.28g}{1.40g}$×100%=91.43%;
故答案为:91.43%;
(5)由于碳化钙生成的氧化钙是碱性氧化物,能和玻璃中的二氧化硅反应生成硅酸钙,从而腐蚀管壁,反应的化学方程式是:CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;
故答案为:CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;
(6)由于电石中含有杂质元素S等,在反应中生成SO2,也能被氢氧化钠溶液吸收干扰CO2的测量,所以需要酸性高锰酸钾溶液除去CO2中混有的SO2等杂质气体;
故答案为;除去CO2中混有的SO2等杂质气体;
(7)通入空气的作用是提供氧气,把生成的二氧化碳气体全部赶入装置丙中吸收;
故答案为:提供氧气,将产生的二氧化碳气体全部赶入丙中充分吸收;
(8)由于空气中也含有CO2,因此a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大,由此方法测得的样品中CaC2的质量分数比方法一中的大;
故答案为:大;由于空气中也含有CO2,因此a处通入空气时,缺一个洗气装置,导致空气中的CO2也被丙吸收,使测量结果偏大.
点评 本题考查了物质组成和性质的实验过程分析判断,主要是乙炔气体中杂质气体的实验验证和除杂实验设计,掌握基础是解题关键,题目难度中等.

| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3-三甲基丁烷 |
| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
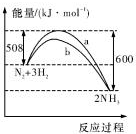
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
C4H10O $\stackrel{H_{2}SO_{4}(浓),△}{→}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H8Br2(丙),丙的结构简式不可能是( )
| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
| A. | Li在N2中燃烧生成Li3N | |
| B. | LiOH是极易溶的强碱 | |
| C. | Be(OH)2既能溶于强酸又能溶于强碱溶液 | |
| D. | 硼酸钠溶液显碱性 |
| A. | 燃烧产物只有CO2和H2O | B. | 与卤素单质发生取代反应 | ||
| C. | 都溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 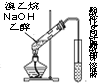 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 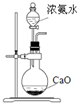 装置可用于实验室制备氨气 |
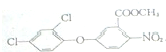
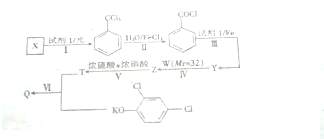

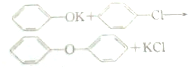
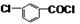 +CH3OH→
+CH3OH→ +HCl.
+HCl. .
.