题目内容
15.下列电子式正确的是( )| A. |  | B. | 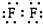 | C. |  | D. |  |
分析 A、氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子;
B、氟气中存在1对氟氟共用电子对,氟原子最外层达到8电子稳定结构;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
D、氮气分子中存在氮氮三键,应该存在3对共用电子对.
解答 解:A、氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B、氟气中存在1对氟氟共用电子对,氟原子最外层达到8电子稳定结构,电子式为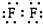 ,故B正确;
,故B正确;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D、氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为 ,故D错误,
,故D错误,
故选B.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
相关题目
5.下列实验合理的是( )
| A. | 用HNO3除去铜粉中混杂的Zn | |
| B. | 通入足量Cl2,除去Fe2(SO4)3溶液中的FeSO4 | |
| C. | 依次通过溴水和碱石灰,除去CH4中的乙烯 | |
| D. | 通过饱和Na2CO3溶液,除去CO2中混杂的SO2 |
6.下列反应所得溶液中一定含有一种溶质的是( )
| A. | 将稀硝酸滴加到装铁粉的试管中 | |
| B. | 向NaOH溶液中通入SO2气体 | |
| C. | 分别将Cl2和SO2通入水中成分反应后的溶液 | |
| D. | 向MgSO4、H2SO4的混合液中加入过量Ba(OH)2溶液 |
3.下列分子或离子中不能跟质子(H+)结合的是( )
| A. | NH3 | B. | H2O | C. | HF | D. | CH4 |
10.下列说法正确的是( )
| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
20.下列对实验现象或操作的解释不合理的是( )
| 操作及现象 | 解释 | |
| A | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | 蛋白质发生了变性 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久置后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeCl3溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 二氧化硫通入溴水,溴水褪色 | 说明二氧化硫具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
4.化合物丙由如下反应得到:
C4H10O $\stackrel{H_{2}SO_{4}(浓),△}{→}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H8Br2(丙),丙的结构简式不可能是( )
C4H10O $\stackrel{H_{2}SO_{4}(浓),△}{→}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H8Br2(丙),丙的结构简式不可能是( )
| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
5.若将14Si的电子排布式写成1s22s22p63s23p${\;}_{x}^{2}$,它违背了( )
| A. | 能量守恒原理 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则 |
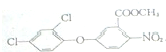
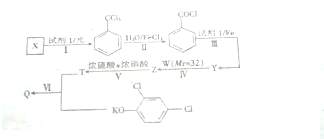

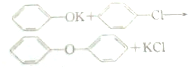
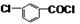 +CH3OH→
+CH3OH→ +HCl.
+HCl. .
.